"Cito!" ir Zāļu valsts aģentūras informatīvs izdevums ārstiem, farmaceitiem un ikvienam veselības aprūpes speciālistam par zāļu un medicīnisko ierīču lietošanas drošumu.
"Cito!" izdevuma numuri ir aplūkojami šeit.
Arhīvs
OKTOBRA IZDEVUMA "CITO!" NUMURĀ LASIET:
Aktuāla drošuma informācija (raksti)
“Esmya”: jauni pasākumi, lai mazinātu reta, bet nopietna aknu bojājuma risku
Ierobežo “Keytruda” un “Tecentriq” lietošanu urīnpūšļa vēža ārstēšanā
HIV zāles dolutegravīrs: pētījums liecina par iedzimtu defektu risku bērniem
Ierobežo prostatas vēža zāļu “Xofigo” lietošanu
Vēstule veselības aprūpes speciālistam: Hidroksietilcietes (HEC) šķīdumi infūzijām (PDF)
- Sāk metotreksātu saturošu zāļu vērtēšanu
Sāk metamizolu saturošu zāļu vērtēšanu
Valsartāna vērtēšana
Vizuāls brīdinājums par zāļu teratogēnisku vai fetotoksisku efektu
Vēstules veselības aprūpes speciālistam ar aktualizētu zāļu drošuma informāciju (PDF)
Jaunā ZVA tīmekļa vietne – īpaši pielāgota veselības aprūpes speciālistiem
Reģistrs
Pārmaiņas Latvijas Zāļu reģistra tiešsaistes meklētājā
Latvijas Zāļu reģistrā iekļautās zāles (PDF)
No Zāļu reģistra izslēgtās zāles (PDF)
Šī izdevuma numura (oktobris, 2018/#73) raksti:
“Esmya”: jauni pasākumi, lai mazinātu reta, bet nopietna aknu bojājuma risku
Kopsavilkums
– kontrindikāciju sievietēm ar zināmiem aknu darbības traucējumiem; – aknu funkciju pārbaudes pirms ārstēšanas,tās laikā un pēc ārstēšanas pārtraukšanas; – pacientes kartīti, kurā sniegta informācija par nepieciešamību uzraudzīt aknu funkcijas un sazināties ar ārstu, ja rodas aknu bojājuma simptomi.
|
Zāles “Esmya” tiek lietotas, lai ārstētu vidēji smagus un smagus dzemdes fibroīdu radītos simptomus. Pierādīts, ka šīs zāles efektīvi mazina asiņošanu un anēmiju, kā arī fibroīdu radītos simptomus. Pierādīts, ka šīs zāles efektīvi mazina asiņošanu un anēmiju, kā arī fibroīdu lielumu.
“Esmya” vērtēšanu veica EMA Farmakovigilances riska vērtēšanas komiteja (PRAC) pēc ziņojumu saņemšanas par smagiem aknu bojājumu gadījumiem, ietverot aknu bojājumus, kuru dēļ jāveic to transplantācija. PRAC secināja, ka zāles “Esmya” var būt veicinājušas dažu smagu aknu bojājumu attīstību.
PRAC ieteikumi tika pārsūtīti Cilvēkiem paredzēto zāļu komitejai (CHMP), un tā pieņēma EMA gala lēmumu. Visām Eiropas Savienības dalībvalstīm juridiski saistošs lēmums ir pieņemts Eiropas Komisijā.
Ārstiem visā Eiropā izplatītas vēstules veselības aprūpes speciālistam, informējot par jaunajiem lietošanas ierobežojumiem, kas piemērojami pēc Eiropas Komisijas lēmuma pieņemšanas.
Vēre
EMA/355940/2018, Esmya: new measures to minimise risk of rare but serious liver injury. European Medicines Agency, homepage. Published: 1 June 2018. Available here.
Ierobežo “Keytruda” un “Tecentriq” lietošanu urīnpūšļa vēža ārstēšanā
Kopsavilkums
|
Sākotnējie abu minēto klīnisko pētījumu dati liecina par mazinātu dzīvildzi saistībā ar “Keytruda” un “Tecentriq”, salīdzinot ar ķīmijterapiju, pacientiem ar lokāli izplatītu vai metastātisku uroteliālu vēzi, kuri iepriekš nav saņēmuši ārstēšanu un kuru audzējiem ir zema PD L1 ekspresija.
Balstoties uz šo pētījumu rezultātiem, “Keytruda” un “Tecentriq” indikācijās uroteliāla vēža ārstēšanai tiek veiktas šādas pārmaiņas:
“Keytruda”
- “Keytruda” monoterapijas veidā indicēts lokāli progresējošas vai metastātiskas urīnizvades sistēmas pārejas šūnu karcinomas ārstēšanai pieaugušiem, kas iepriekš saņēmuši platīna ķīmijterapiju (skatīt zāļu apraksta 5.1. apakšpunktu).
- “Keytruda” monoterapijas veidā indicēts lokāli progresējošas vai metastātiskas urīnizvades sistēmas pārejas šūnu karcinomas ārstēšanai pieaugušiem, kas nav piemēroti cisplatīna ķīmijterapijai un kuru audzēju PD L1 ekspresijas kombinētais pozitīvais vērtējums (CPS) ir ≥10 (skatīt zāļu apraksta 5.1. apakšpunktu).
“Tecentriq”
- “Tecentriq” monoterapijā indicēts lokāli progresējošas vai metastātiskas urotēlija karcinomas (UK) ārstēšanai pieaugušiem pacientiem pēc iepriekš veiktas platīna ķīmijterapijas vai gadījumos, kad nav piemērota cisplatīna lietošana un audzēju PD L1 ekspresija ir ≥5% (skatīt zāļu apraksta 5.1. apakšpunktu).
Pašlaik abi minētie klīniskie pētījumi tiek turpināti.
“Keytruda” un “Tecentriq” datu vērtēšanu veica EMA Cilvēkiem paredzēto zāļu komiteja (CHMP). CHMP lēmums tiks nosūtīts Eiropas Komisijai, kas pieņems visām Eiropas Savienības (ES) dalībvalstīm juridiski saistošu gala lēmumu.
Veselības aprūpes speciālistiem ES izplatīta vēstule ar detalizētu informāciju par šiem ieteikumiem un abiem pašlaik noritošiem klīniskiem pētījumiem.
Jāmin, ka “Keytruda” un “Tecentriq” joprojām drīkst lietot par pirmās izvēles ārstniecības līdzekļiem pacientiem ar uroteliālu vēzi, kuriem ir augsts PD L1 līmenis (skatiet pilno indikāciju izklāstu turpmāk). Pārmaiņas arī neskar šo zāļu lietošanu pacientiem, kam ir uroteliāls vēzis un kas saņēmuši ķīmijterapiju, vai pacientiem ar cita veida vēzi, kura ārstēšanai šīs zāles ir apstiprinātas.
Vairāk par šīm zālēm
“Keytruda” reģistrēts Eiropas Savienībā uroteliāla vēža, melanomas, nesīkšūnu plaušu vēža un klasiskās Hodžkina limfomas ārstēšanai. “Tecentriq” reģistrēts uroteliāla vēža un nesīkšūnu plaušu vēža ārstēšanai.
Dažām vēža šūnām ir olbaltums (PD L1), kas var saistīties ar imūnsistēmas šūnu receptoru (PD 1) un atturēt šīs imūnsistēmas šūnas no uzbrukšanas vēža šūnām. “Keytruda” un “Tecentriq” darbojas dažādos veidos, lai neļautu vēža šūnām traucēt imūnšūnu darbību – “Keytruda” iedarbojas uz PD-1 receptoru imūnšūnu virsmām un “Tecentriq” iedarbojas uz PD L1 olbaltumu vēža šūnās.
1- Keynote-361 pētījums ar Keytruda un IMvigor130 pētījums ar Tecentriq.
Vēre
EMA/364553/2018, EMA restricts use of Keytruda and Tecentriq in bladder cancer. European Medicines Agency, homepage. Published: 1 June 2018. Available here.
HIV zāles dolutegravīrs: pētījums liecina par iedzimtu defektu risku bērniem
Kopsavilkums
– dolutegravīru saturošas HIV zāles nedrīkst ordinēt sievietēm, kas plāno grūtniecību; – sievietēm, kam var iestāties grūtniecība, dolutegravīra lietošanas laikā jālieto efektīva kontracepcija; – ja sievietei, kas lieto dolutegravīru, tiek apstiprināta grūtniecība pirmajā trimestrī, mainiet terapiju uz citu ārstniecības līdzekli, izņemot gadījumus, kad nav piemērotas alternatīvas. |
Pētījumā, kurā aplūkoti 11 558 HIV nēsātājām dzimuši bērni Botsvānā, konstatēts, ka 0,9% bērnu (4 no 426), kuru mātēm grūtniecība iestājās dolutegravīra lietošanas laikā, bija nervu caurulītes defekts salīdzinājumā ar 0,1% bērnu (14 no 11 173), kuru mātes lietoja citas HIV zāles.
Paaugstināts nervu caurulītes defekta risks netika novērots bērniem, kuru mates sāka dolutegravīra lietošanu vēlāk grūtniecības laikā.
Jāmin, ka reproduktīvās toksikoloģijas pētījumos nav konstatētas būtiskas atrades. Arī citi dati par dolutegravīra lietošanu grūtniecības laikā, to vidū Antiretrovirālo līdzekļu grūtniecības reģistra dati, klīnisko pētījumu un pēcreģistrācijas lietošanas dati nenorāda uz paaugstinātu nervu caurulītes defektu risku.
Pēc vērtēšanas pabeigšanas EMA sniegs papildu ieteikumus.
Vairāk par šīm zālēm
Dolutegravīrs ir integrāzes inhibitors. Šīs zāles bloķē par integrāzi sauktā enzīma darbību, kas nepieciešama HIV vīrusam, lai tas spētu vairoties cilvēka organismā. Lietojot dolutegravīru kopā ar citām zālēm, tas palīdz novērst HIV izplatību un saglabāt zemu vīrusa līmeni asinīs.
Dolutegravīrs neizārstē HIV infekciju vai AIDS, bet var aizkavēt imūnsistēmas bojājumu un ar AIDS saistīto infekcijas un citu slimību attīstību. Dolutegravīrs reģistrēts Eiropas Savienībā kopš 2014. gada. Tas tiek izplatīts atsevišķi ar nosaukumu “Tivicay” un kombinācijā ar lamivudīnu un abakavīru ar nosaukumu “Triumeq”.
Vēre
EMA/295960/2018, New study suggests risk of birth defects in babies born to women on HIV medicine dolutegravir. European Medicines Agency, homepage. Published: 18 May 2018. Available here.
Ierobežo prostatas vēža zāļu “Xofigo” lietošanu
Kopsavilkums
|
EMA veica “Xofigo” vērtēšanu saistībā ar klīniskā pētījuma datiem, kas liecināja, ka pacientiem, kuri saņēma “Xofigo” kombinācijā ar “Zytiga” un prednizonu vai prednizolonu, iespējams, pastāv paaugstināts mirstības un lūzumu risks nekā pacientiem, kas saņēma placebo kombinācijā ar “Zytiga” un prednizonu vai prednizolonu. Pētījumā tika iekļauti pacienti bez simptomiem vai ar viegliem simptomiem, lai gan “Xofigo” reģistrēts lietošanai pacientiem ar simptomiem.
Turklāt šajā pētījumā izmantotā zāļu kombinācija tagad ir kontrindicēta. Šajā pētījumā pacienti, kas saņēma zāļu kombināciju ar “Xofigo”, nomira vidēji 2,6 mēnešus agrāk nekā pacienti, kas saņēma zāļu kombināciju ar placebo. Lūzumi novēroti 29% pacientu, kas saņēma zāļu kombināciju ar “Xofigo”, un 11% pacientu, kas saņēma zāļu kombināciju ar placebo.
Detalizēta informācija
- “Xofigo” lietošana saistīta ar augstāku kaulu lūzumu risku. Klīniskā pētījumā, kurā tika pētīta “Xofigo” lietošana kombinācijā ar abiraterona acetātu un prednizonu vai prednizolonu pacientiem ar asimptomātisku, kastrācijas rezistentu prostatas vēzi vai tā viegliem simptomiem, tika novērots arī, iespējams, paaugstināts nāves risks.
- “Xofigo” drīkst lietot tikai monoterapijā vai kombinācijā ar LHRH analogu, lai ārstētu pieaugušus pacientus, kam ir metastātisks, kastrācijas rezistents prostatas vēzis, simptomātiskas metastāzes kaulos bez metastāzēm citos orgānos un kam vēzis progresē pēc vismaz diviem iepriekšējiem sistēmiskiem tā ārstēšanas kursiem (ar zālēm, kas nav LHRH analogi) vai kam citu šī vēža sistēmisko ārstniecības līdzekļu lietošana nav piemērota.
- “Xofigo” lietošana kombinācijā ar abiraterona acetātu un prednizonu vai prednizolonu ir kontrindicēta. Turklāt “Xofigo” lietošanu nedrīkst sāk pirmo 5 dienu laikā pēc pēdējās abiraterona un prednizona vai prednizolona devas. Vismaz 30 dienas pēc pēdējās “Xofigo” lietošanas reizes nedrīkst sākt nākamā sistēmiskā ārstniecības līdzekļa lietošanu.
- “Xofigo” lietošana nav ieteicama pacientiem ar nelielu osteoblastisko kaulu metastāžu skaitu un pacientiem, kam ir tikai asimptomātiskas kaulu metastāzes. Tāpat nav ieteicama tā lietošana kombinācijā ar sistēmiskiem vēža ārstniecības līdzekļiem, kas nav LHRH analogi.
- Pacientiem ar viegliem simptomiem rūpīgi jāvērtē ārstēšanas guvums un risks, ņemot vērā, ka vēlamam ārstēšanas rezultātam nepieciešama augsta osteoblastiskā aktivitāte (detalizētāku informāciju skatīt turpmāk).
- Pirms “Xofigo” lietošanas un tās laikā jāveic pacienta kaulu stāvokļa pārbaude (piemēram, ar scintigrāfijas, kaulu minerālblīvuma mērījumu palīdzību) un lūzumu riska izvērtēšana (piemēram, osteoporoze, mazāk nekā 6 kaulu metastāzes, zāļu lietošana, kas paaugstina lūzumu risku, zems ķermeņa masas indekss). Uzraudzība jāturpina vismaz 24 mēnešus.
- Pacientiem ar sākotnēji paaugstinātu lūzumu risku rūpīgi jāapsver ārstēšanas guvuma un riska attiecība.
- Konstatēts, ka bisfosfonātu vai denozumaba lietošana mazina lūzumu biežumu pacientiem, kas lieto “Xofigo”. Tādēļ šie profilakses pasākumi apsverami pirms “Xofigo” lietošanas vai tās
atsākšanas.
EMA ieteikumi balstīti uz vērtējumu par datiem no randomizēta, dubultakla, placebo kontrolēta III fāzes pētījuma (ERA-223), kas norāda uz lielāku lūzumu biežumu (28,6% salīdzinājumā ar 11,4%), iespējamu mediānās kopējās dzīvildzes samazinājumu (30,7 mēneši salīdzinājumā ar 33,3 mēnešiem, HR 1,195, 95% ticamības intervāls (CI) 0,950-1,505, p=0,13) un palielinātu risku radioloģiskai vēža progresēšanai ārpus kauliem (HR 1,376, 95% CI 0,972, 1,948, p=0,07) tiem pacientiem, kas saņēma “Xofigo” kombinācijā ar abiraterona acetātu un prednizonu vai prednizolonu (n=401), salīdzinājumā ar pacientiem, kas saņēma placebo kombinācijā ar abiraterona acetātu un prednizonu vai prednizolonu (n=405). Visvairāk palielināts lūzumu risks tika konstatēts pacientiem ar zināmu osteoporozi un pacientiem ar mazāk nekā 6 kaulu metastāzēm.
Cits randomizēts, dubultakls, placebo kontrolēts III fāzes klīniskais pētījums (ALSYMPCA) nespēja uzrādīt “Xofigo” lietošanas sniegtu statistiski nozīmīgu dzīvildzes uzlabojumu apakšgrupās, kur bija pacienti ar mazāk nekā 6 metastāzēm (rādijs-223 salīdzinājumā ar placebo – HR 0,901; 95% CI 0,5531,466, p=0,674) vai sākotnējo kopējās sārmainās fosfatāzes līmeni <222 vienībām litrā (HR 0,823, 95% CI 0,6331,068, p=0,142). Tas norāda, ka šīs ārstēšanas efektivitāte var būt mazināta pacientiem ar zemu osteoblastiskās aktivitātes līmeni kaulu metastāzēs.
Vairāk par šīm zālēm
“Xofigo” pašlaik tiek lietots, lai ārstētu pieaugušus vīriešus, kam ir prostatas vēzis. Tas reģistrēts lietošanai gadījumos, kad medicīniska vai ķirurģiska kastrācija nav efektīva un vēzis izplatījies uz kauliem, izraisot tādus simptomus kā sāpes, taču nav datu, ka vēzis būtu izplatījies uz citiem iekšējiem orgāniem.
Vēre
EMA/500948/2018, EMA restricts use of prostate cancer medicine Xofigo. European Medicines Agency, homepage. Published: 27 July 2018. Available here.
Sāk metotreksātu saturošu zāļu vērtēšanu
Kopsavilkums Eiropas Zāļu aģentūrā šo zāļu vērtēšana sākta saistībā ar dozēšanas kļūdu risku. |
Metotreksātu saturošas zāles lieto vēža, to vidū akūtas limfoblastiskas leikēmijas, kā arī dažādu iekaisīgu slimību ārstēšanai – reimatoīda artrīta, juvenīla idiopātiska artrīta, psoriāzes un psoriātiska artrīta gadījumā. Iekaisīgu slimību ārstēšanai metotreksāts tiek lietots vienu reizi nedēļā. Savukārt dažādu vēža veidu terapijā šo zāļu deva ir lielāka un tās tiek lietotas biežāk. Kļūdu dēļ daži pacienti saņēmuši zāles katru dienu nevis reizi nedēļā. Atsevišķos gadījumos tam bijušas nopietnas sekas.
Lai gan ar metotreksātu saistītais zāļu dozēšanas risks zināms jau vairākus gadus un dažās Eiropas Savienības dalībvalstīs ieviesti vairāki pasākumi šā riska mazināšanai, joprojām tiek novērotas nopietnas ar pārdozēšanu saistītas zāļu blaknes, arī letāli gadījumi.
Tādēļ Spānijas Zāļu un veselības produktu aģentūra lūgusi Eiropas Zāļu aģentūru veikt metotreksātu saturošu zāļu vērtēšanu, lai noskaidrotu iemeslus, kādēļ joprojām tiek pieļauts minēto zāļu dozēšanas kļūdu risks. Pēc vērtēšanas tiks veikti atbilstoši pasākumi šo kļūdu novēršanai.
Vēre
EMA/215649/2018, EMA reviewing risk of dosing errors with methotrexate. European Medicines Agency, homepage. Published: 13 April 2018. Available here.
Sāk metamizolu saturošu zāļu vērtēšanu
Kopsavilkums Šī pretsāpju līdzekļa vērtēšanu Eiropas Zāļu aģentūrā (EMA) rosinājusi devu un kontrindikāciju |
Vērtēšana sākta pēc Polijas Zāļu aģentūras lūguma saistībā ar dažādās dalībvalstīs pastāvošām būtiskām atšķirībām attiecībā uz šo zāļu ieteicamo maksimālo dienas devu un kontrindikācijām to lietošanai grūtniecības vai zīdīšanas laikā.
EMA Cilvēkiem paredzēto zāļu komiteja (CHMP) vērtēs pieejamos pierādījumus un sniegs ieteikumus, vai nepieciešams mainīt metamizolu saturošo zāļu reģistrācijas apliecības visā Eiropas Savienībā.
Vairāk par šīm zālēm
Metamizols (zināms arī kā dipirons) Eiropas Savienībā tiek lietots daudzus desmitus gadu iekšķīgi, supozitoriju vai injekciju veidā, lai ārstētu stipras sāpes un drudzi, ko nevar kontrolēt ar citiem līdzekļiem.
Metamizolu saturošās zāles pieejamas Bulgārijā, Horvātijā, Itālijā, Lietuvā, Polijā, Rumānijā, Slovēnijā, Spānijā, Ungārijā un Vācijā ar dažādiem nosaukumiem, to vidū Algifen, Algifen Neo, Algi Mabo, Algoblock, Algocalmin, Algopyrin, Algozone, Alindor, Alkagin, Alvotor, Amizolmet, Analgin, Benalgin, Benlek, Berlosin, Buscapina Compositum, Dialgin, Dolocalma, Flamborin, Freshalgin, Gardan, Generalgin, Hexalgin, Litalgin, Locamin, Metagelan, Metalgial, Metamilan, Metamistad, Metapyrin, Metarapid, Nevralgin, Nodoryl, Nolotil, Novalgin, Novalgina, Novalgine, Novaminsulfon, Novocalmin, Panalgorin, Parakofdal, Piafen, Piralgin, Proalgin, Pyralgin, Pyralgina, Quarelin, Scopolan Compositum, Spasmalgon, Spasmoblok, Tempalgin un Tempimet.
Vēre
EMA/338589/2018, EMA begins review of medicines containing metamizole. European Medicines Agency, homepage. Published: 1 June 2018. Available here.
Valsartāna vērtēšana
Kopsavilkums
|
Valsartāna vērtēšana tiek veikta, lai noskaidrotu NDMA piemaisījuma daudzumu šajās zālēs un tā iespējamo ietekmi uz pacientiem, kas tās lietojuši.
NDMA pieder nitrozamīnu klasei. Šīs vielas tiek klasificētas par potenciāli kancerogēnām cilvēkiem. Saskaņā ar EMA novērtējumu, aptuveni 1 no 5000 pieaugušiem pacientiem, kas no 2012. gada jūlija līdz 2018. gada jūlijam katru dienu lietoja skarto valsartānu saturošo zāļu lielāko devu (320 mg), pastāv vēža risks dzīves laikā. Tomēr šis risks uzskatāms par zemu. Pacienti, kas ārstēti ar mazāku zāļu devu vai īsāku periodu, ir pakļauti zemākam riskam. EMA riska novērtējums balstīts uz vidējo NDMA koncentrāciju, kas atklāta “Zhejiang Huahai” ražotā aktīvā vielā kopš 2012. gada (laika, kad uzņēmums veica pārmaiņas ražošanas procesā), un pieņemot, ka viss NDMA “pārnests” uz gala produktu.
Vērtēšanas gaitā EMA noskaidrojusi, ka zems NDMA līmenis konstatēts valsartānā, ko ražo arī cits Ķīnas uzņēmums “Zhejiang Tianyu”. Zināms, ka šī uzņēmuma ražotā valsartānā NDMA bija mazāk nekā “Zhejiang Huahai” ražotā.
Pašlaik EMA veic arī līdzīgas vielas – N-nitrosodietilamīna (NDEA) – ietekmes vērtēšanu. Arī šī viela atklāta valsartānā, ko “Zhejiang Huahai” ražoja pirms ražošanas procesa pārmaiņu veikšanas 2012. gadā. Pašlaik pieejamie dati par NDEA koncentrāciju ir ļoti ierobežoti.
Zāles, kas saturēja “Zhejiang Huahai” vai “Zhejiang Tianyu” ražoto valsartānu, ES vairs netiek izplatītas un atsauktas no tirgus. Abiem uzņēmumiem šobrīd nav atļaujas ražot valsartānu zālēm Eiropas Savienībā. Latvijā kopš 2018. gada jūlijā tika atsauktas EMA vērtēto valsartānu saturošas zāļu sērijas, un līdz ar to tās Latvijas tirgū nav pieejamas. Latvijā reģistrēto valsartānu saturošu zāļu reģistrācijas apliecības īpašnieks “Medana Pharma SA” (Polija) atsaucis no Latvijas tirgus zāles “Vanatex 160 mg apvalkotās tabletes” (reģ. nr. 10-0437), “Vanatex 80 mg apvalkotās tabletes” (reģ. nr. 10-0438), “Vanatex HCT 160 mg/12,5 mg apvalkotās tabletes” (reģ. nr. 11-0162) un “Vanatex HCT 160 mg/25 mg apvalkotās tabletes” (reģ. nr. 11-0163). Reģistrācijas apliecības īpašnieks “Egis Pharmaceuticals PLC” (Ungārija) informēja Zāļu valsts aģentūru par zāļu “Tensart HCT 160/12,5 mg apvalkotās tabletes” (reģ. nr. 09-0085) atsaukšanu. Minēto valsartānu saturošu zāļu sēriju atsaukšana notika visā šo zāļu izplatīšanas ķēdē – gan zāļu ražošanas uzņēmumā, gan lieltirgotavās un aptiekās. Zāļu atsaukšanu uzraudzīja Veselības inspekcija.
Eiropas Savienības (ES) regulatorās iestādes veikušas inspekcijas abu uzņēmumu ražotnēs Ķīnā un pašlaik vērtē pārbaudēs atklāto. EMA turpina cieši sadarboties ar nacionālām atbildīgām iestādēm, starptautiskiem sadarbības partneriem, lai noskaidrotu, kādēļ aktīvā vielā bijuši piemaisījumi.
Balstoties uz vērtēšanas rezultātu, ES atbildīgās iestādes veiks nepieciešamos pasākumus, lai nodrošinātu, ka nākotnē neatkārtojas līdzīgi gadījumi. Papildu informāciju veselības aprūpes speciālistiem un pacientiem par valsartānu saturošām zālēm, arī par tajās esošo piemaisījumu ietekmi, EMA sniegs pēc šo zāļu vērtēšanas pabeigšanas.
Vairāk par šīm zālēm
Valsartāns ir angiotenzīna II receptoru blokators (ARB). ARB saturošas zāles iedarbojas, bloķējot angiotenzīna II darbību. Valsartāns tiek lietots pacientiem ar paaugstinātu asinsspiedienu, lai to regulētu un mazinātu tādus veselības traucējumus kā sirds mazspēja un sirdslēkme. Šīs zāles tiek lietotas arī pacientiem, kam nesen bijusi sirdslēkme. Latvijā ir reģistrētas dažādas ARB saturošas zāles, kuru aktīvās vielas ražo dažādi ražotāji.
Vēre
EMA/562158/2018, Update on medicines containing valsartan from Zhejiang Tianyu. European Medicines Agency, homepage. Available here.
Vizuāls brīdinājums par zāļu teratogēnisku vai fetotoksisku efektu
Kopsavilkums
|
Zālēm, kam papildu riska mazināšanas pasākumu ietvaros pieprasīts uz ārējā iepakojuma izvietot vizuālu atgādinājumu, lai brīdinātu pacientus par zāļu teratogēnisko vai fetotoksisko iedarbību, piktogrammai un ierāmētajam brīdinājumam jāatrodas uz atsevišķas ārējā iepakojuma virsmas, uz kuras nav cita veida marķējuma. Ierāmētā brīdinājuma tekstam jābūt tādā(-s) valodā(-s), kādā(-s) ir marķējuma teksts.
Ierāmētajam brīdinājumam un piktogrammai jāatrodas blakus.
Piktogrammai jāietver sarkans trīsstūris uz balta fona vismaz centimetru diametrā un grūtnieces attēls melnā krāsā. Piktogrammai jābūt salasāmai, un tā jāpielāgo zāļu ārējā iepakojuma lielumam.
Jaunā ZVA tīmekļa vietne – īpaši pielāgota veselības aprūpes speciālistiem
Kopsavilkums Ārstiem, farmaceitiem un ikvienam veselības aprūpes speciālistam veltīta atsevišķa sadaļa |
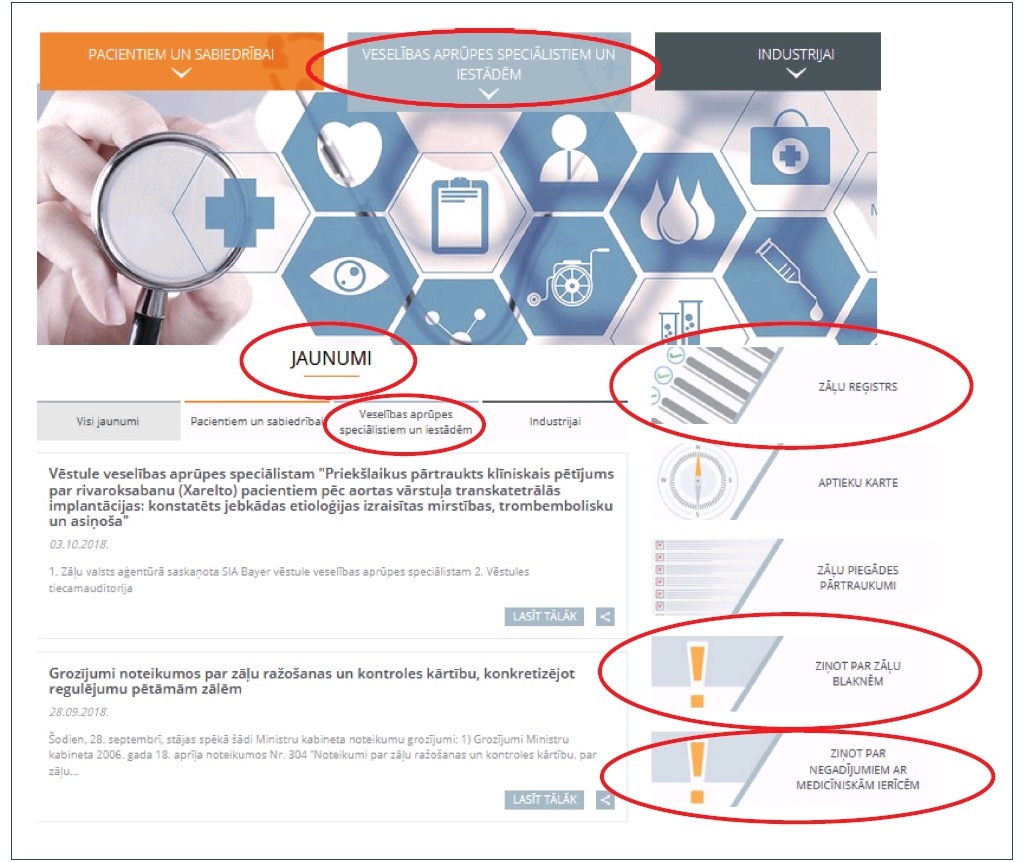
Atverot jauno tīmekļa vietni, labajā sāna slejā uzreiz ir pieejams Zāļu reģistrs, kurā iekļauta oficiāla un aktuāla informācija par Latvijā reģistrētām zālēm, un iespēja iesniegt ZVA ziņojumu par zāļu blaknēm un ziņot par negadījumiem ar medicīniskām ierīcēm (skat. 1. att.). Jaunumu sadaļā veselības aprūpes speciālisti var gūt aktuālu ZVA un Eiropas Zāļu aģentūras drošuma informāciju.
1. attēls. Jaunā Zāļu valsts aģentūras tīmekļa vietne.
Veselības aprūpes speciālistiem paredzētajā tīmekļa vietnes sadaļā “Farmakovigilance” publicētas ZVA saskaņotās vēstules veselības aprūpes speciālistiem un zāļu riska mazināšanas izglītojoši materiāli (skat. 2. att.). Šie papildu riska mazināšanas pasākumu materiāli paredzēti veselības aprūpes speciālistiem un pacientiem, lai sniegtu norādījumus, kā mazināt un/vai novērst ar zāļu lietošanu saistītus riskus. Minētos materiālus izstrādā zāļu reģistrācijas apliecības īpašnieki zālēm, kam noteikti papildu riska mazināšanas pasākumi, un tie pirms izplatīšanas tiek saskaņoti ZVA.
2. attēls. Sadaļa “Veselības aprūpes speciālistiem un iestādēm > Zāles > Farmakovigilance”.

Sadaļā ietvertais e-mācību modulis “Zāļu blakusparādības: ziņošana padara zāles drošākas” sniedz iespēju paplašināt zināšanas par zāļu blakņu ziņošanas nozīmi un to, kā un par kādām zāļu blaknēm nepieciešams paziņot Zāļu valsts aģentūrai. Šis modulis ir saņēmis augstāko akreditācijas apliecinājumu no Eiropas Akreditācijas padomes tālākizglītībai medicīnas jomā (European Accreditation Council for Continuing Medical Education, EACCME). Par moduļa apgūšanu (kas aizņem 45–60 min un ir bezmaksas) tiek piešķirts 1 EACCME kredītpunkts.
Publicēti ir arī saraksti ar zālēm, kurām ir piemērota papildu uzraudzība (par papildu uzraudzību liecina šo zāļu lietošanas instrukcijā un zāļu aprakstā ievietots melns apgriezts trīsstūris) un cita svarīga drošuma informācija.
Sadaļā “Veselības aprūpes speciālistiem un iestādēm” ir pieejams ATĶ (anatomiski terapeitiski ķīmisko) kodu klasifikators latviešu un angļu valodā (skat. 3. att.). Saskaņā ar ATĶ klasifikācijas sistēmu zāles tiek iedalītas piecos līmeņos atkarībā no to iedarbības uz orgāniem vai orgānu sistēmām, to terapeitiskām, farmakoloģiskām un ķīmiskām īpašībām un aktīvās vielas.
3. attēls. Sadaļa “Veselības aprūpes speciālistiem un iestādēm”.

Tāpat esat aicināti izmantot arī Farmācijas terminu sarakstu un zālēs lietoto aktīvo vielu un palīgvielu nosaukumu sarakstu latviešu, latīņu un angļu valodās un tajā ietvertās meklēšanas iespējas, lai noskaidrotu precīzu zāļu aktīvo vielu un palīgvielu, tajā skaitā ārstniecības augu, nosaukumus. Sarakstā ietverti gandrīz 5 000 vielu nosaukumi, un tas ir atrodams, ZVA tīmekļa vietnē klikšķinot uz apakšsadaļas ”Vielu saraksts”.
Tīmekļa vietnē iespējams aplūkot arī informāciju par medicīniskām ierīcēm, asinīm, audiem, šūnām un orgānu izmantošanas vietām, tai skaitā arī sniegt vigilances ziņojumus.
Ceram, ka ZVA tīmekļa vietnē pieejamā informācija būs Jums noderīga ārstniecības procesa nodrošināšanā arī turpmāk!
Pārmaiņas Latvijas Zāļu reģistra tiešsaistes meklētājā
Lasīt vairāk
Kompensējamo zāļu sarakstā iekļautām zālēm – speciāla norāde
Latvijas Zāļu reģistra tiešsaistes meklētājā, kas ir pieejams Zāļu valsts aģentūras (ZVA) tīmekļa vietnes www.zva.gov.lv sadaļā “Zāļu reģistrs”, zālēm, kuras ir iekļautas valsts Kompensējamo zāļu sarakstā (KZS), tagad ir pievienota speciāla norāde “KZS”, nodrošinot pilnīgāku un plašāku informāciju par medikamentiem veselības aprūpes speciālistiem un pacientiem.
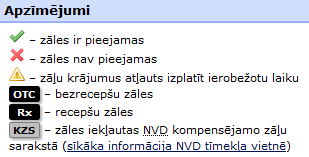
Norādei par zāļu esamību valsts Kompensējamo zāļu sarakstā ir informatīva nozīme. Aktuālu un precīzu informāciju, tai skaitā par valstī spēkā esošiem KZS sarakstiem (A, B, C un M saraksts), kuros tieši zāles ir iekļautas, aicinām skatīt Nacionālā veselības dienesta (NVD) tīmekļa vietnes www.vmnvd.gov.lv sadaļā “Kompensējamie medikamenti > Kompensācijas kārtība”.
Var atlasīt visas noteiktas zāļu grupas zāles
Reģistra paplašinātajā meklēšanas formā ir integrēts ATĶ kodu klasifikators*, nodrošinot iespēju atlasīt visas noteiktas zāļu grupas zāles. Piemēram, tagad meklētājā var izvēlēties zāļu grupu, kā “Pretaudzēju līdzekļi un imūnmodulatori (L)”, “Sistēmiski lietojamie pretinfekcijas līdzekļi (J)”, “Dermatoloģiskie līdzekļi (D)” un citas zāļu grupas. Reģistrā ir saglabāta arī iespēja norādīt precīzu ATĶ kodu, ja vien lietotājam tas ir zināms.
Vieglāk un ātrāk pārlūkot – tai skaitā arī informāciju par zāļu pieejamību, cenu
Lai veselības aprūpes speciālistiem, pacientiem un ikvienam interesentam nepieciešamā informācija par zālēm būtu ātri atrodama un viegli pārlūkojama, Reģistra tiešsaistes meklētājā ir pilnveidots informācijas izkārtojums un apjoms.
Pirmajā logā pie konkrētām zālēm sniegta informācija par zāļu pieejamību un otrajā – par izsniegšanas kārtību (recepšu vai bezrecepšu zāles), tai seko zāļu un aktīvās vielas nosaukums, ATĶ kods, maksimālais zāļu cenas diapazons (eiro ar PVN) atkarībā no iepakojuma lieluma un zāļu reģistrācijas īpašnieka nosaukums.
Reģistrā uzreiz tiek atlasītas tikai tās zāles, kurām ir norādīta cena. (Zāļu lieltirgotavām ir tiesības izplatīt tikai tās zāles, par kuru cenām ir sniegta informācija ZVA saskaņā ar normatīvajiem aktiem par zāļu cenu veidošanas principiem. Šī prasība nav attiecināma uz nereģistrētām zālēm.) Lai attēlotu visas zāles, arī tās, kurām cena nav norādīta, lietotājam jāveic speciāla atzīme meklēšanas parametros.
Atlasot zāles, meklētājā uzreiz vairs nav redzami zāļu reģistrācijas numuri, bet to norādīšanu lietotājs pats var izvēlēties. Pārskatāmības nolūkā ir saīsināti kolonnu nosaukumi un tie lietotājam, meklējot zāles, vienmēr ir redzami Reģistra augšējā joslā. Meklētājā veikti arī citi uzlabojumi.
Latvijas Zāļu reģistrs – datubāze, kurā ir oficiāla, aktuāla un visaptveroša informācija par Latvijā reģistrētām un izplatītām zālēm, ietverot arī Eiropā centralizēti reģistrētas zāles. Reģistrā ir atrodami arī zāļu apraksti un lietošanas instrukcijas, kā arī publicētas vēstules veselības aprūpes speciālistam un zāļu riska mazināšanas izglītojoši materiāli.
_______________________













