Citas valsts iepakojums Latvijā
Saskaņā ar normatīvajiem aktiem par zāļu marķēšanas kārtību un zāļu lietošanas instrukcijai izvirzītajām prasībām, Latvijā izplatītajām zālēm informācija marķējumā un lietošanas instrukcijā jānorāda valsts valodā. Situācijā, ja zāļu reģistrācijas apliecības īpašnieks nevar nodrošināt iepriekš minētās informācijas pieejamību valsts valodā (t.sk. zāļu ražotājam pārpakojot zāles), pastāv izņēmuma gadījumi zāļu izplatīšanai Latvijā citas valsts tirgum paredzētajos iepakojumos.
Konsolidētā versija noteikumiem par zāļu marķēšanas kārtību un zāļu lietošanas instrukcijai izvirzāmajām prasībām pieejama šeit.
Paziņošana par citas valsts tirgum paredzēto zāļu izplatīšanu
Kopš 2022. gada 1. janvāra Ministru kabineta 2006. gada 17. janvāra noteikumi Nr. 57 "Noteikumi par zāļu marķēšanas kārtību un zāļu lietošanas instrukcijai izvirzāmajām prasībām" (turpmāk – Noteikumi Nr. 57) cita starpā nosaka pastāvīgo regulējumu attiecībā uz Latvijā reģistrēto zāļu izplatīšanu citai Eiropas Savienības dalībvalsts vai Eiropas Ekonomikas zonas valsts (turpmāk - ES/EEZ valsts) tirgum paredzētajos iepakojumos, nosakot gadījumus, kuros reģistrācijas apliecības īpašnieks var paziņot par to izplatīšanu Zāļu valsts aģentūrai (turpmāk - ZVA) un izplatīt zāles bez atļaujas saņemšanas ZVA un zāļu pārpakošanas.
2024. gada 20. martā stājās spēkā 2024. gada 12. marta Ministru kabineta noteikumi Nr.166 “Grozījumi Ministru kabineta 2006.gada 17.janvāra noteikumos Nr.57 “Noteikumi par zāļu marķēšanas kārtību un zāļu lietošanas instrukcijai izvirzāmajām prasībām”, paplašinot to izņēmumu gadījumu skaitu, kad komersantiem vairs nav nepieciešams saņemt ZVA atļauju, lai izplatītu Latvijā zāles citas valsts tirgum paredzētos iepakojumos.
Turpmāk komersanti arī var izplatīt Latvijā reģistrētās zāles citas valsts tirgum paredzētos iepakojumos, paziņojot par to ZVA - gadījumā, kad Latvijas Zāļu reģistrā nav iekļauti citi analogi (tās ir vienīgās reģistrētās zāles ar šādu aktīvo vielu, stiprumu un zāļu formu).
Ceļvedis, kuros gadījumos iesniedzams paziņojums un kuros nepieciešams saņemt ZVA piekrišanu:
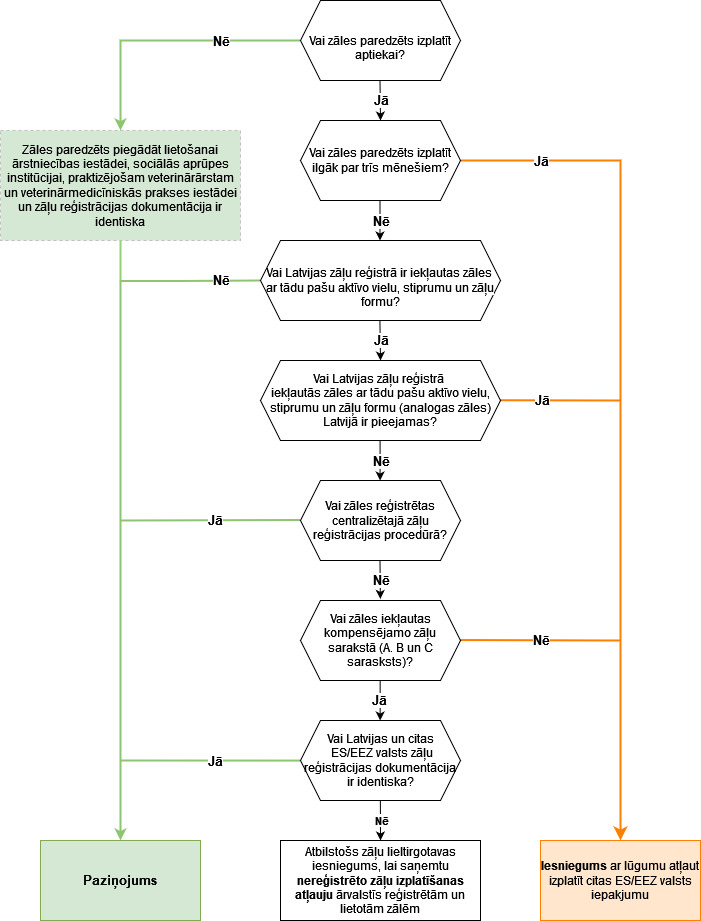
Paziņojumā jāiekļauj informācija par:
- zāļu nosaukumu,
- stiprumu, iepakojuma lielumu un daudzumu,
- sērijas numuru un derīguma termiņu,
- valsti, kuras tirgum ir paredzētas zāles, papildu informāciju zāļu pieejamības analīzei (zāļu izplatīšanas ilgumu un informāciju, kad tiks nodrošināts iepakojuma marķējums un lietošanas instrukcija valsts valodā, piemēram, zāles pārpakojot).
Vēršam uzmanību, ka reģistrācijas apliecības īpašnieks ir atbildīgs par to, ka zāļu ražotājs vai zāļu lieltirgotava nodrošina zāļu lietošanas instrukciju valsts valodā un marķējuma teksta tulkojuma pievienošanu attiecīgajā skaitā katra konkrētā zāļu sūtījuma zālēm:
- atbilstoši ārstniecības iestādes, sociālās aprūpes institūcijas, praktizējošā veterinārārsta un veterinārmedicīniskās prakses iestādes pieprasījumam;
- lai izsniedzot aptiekā attiecīgās zāles pacientam, farmaceits, farmaceita asistents vai ārstniecības persona, kopā ar zālēm varētu izsniegt pacientam attiecīgo zāļu marķējuma tulkojumu un zāļu lietošanas instrukciju valsts valodā un vērst uzmanību uz to, ka zāles nav Latvijas tirgum paredzētajā iepakojumā, kā arī izskaidro pacientam zāļu pareizu lietošanu.
Tāpat aicinām pārliecināties, ka zāļu lietošanas instrukcijas un marķējumu tulkojumi, kas tiek pievienoti zālēm, atbilst normatīvo aktu par zāļu marķēšanas kārtību un zāļu lietošanas instrukcijai izvirzītajām prasībām (tai skaitā, piemēram, tie nav dokumentu projekti vai maketi, ir norādīts lietošanas instrukcijas pēdējās apstiprināšanas datums, ir norādīta ZVA kontaktinformācija attiecībā uz ziņošanu par blakusparādībām, visa marķējuma informācija ir attiecināma uz konkrēto produktu un nesatur lieku informāciju, kas var maldināt zāļu lietotāju), kā arī ir ņemtas vērā vispārējās vadlīnijas par prasībām lietošanas instrukcijai un marķējuma tekstam.
Atgādinām arī par nepieciešamību nodrošināt, ka zāļu lieltirgotavas, kas saņem attiecīgos zaļu iepakojumus, prasībām atbilstošas lietošanas instrukcijas un marķējuma tulkojumus, ko pievienot izplatāmajiem zāļu iepakojumiem, saņem pietiekamā daudzumā.
Aicinām pārliecināties, ka:
- paziņojumā minētajām zālēm konkrētajā ES/EEZ izcelsmes valstī un Latvijā ir identiska to reģistrācijas dokumentācija;
- gadījumos, kad zāles tiek izplatītas aptiekām, citas valsts tirgum paredzēto zāļu izplatīšanas vairumtirdzniecībā ilgums nepārsniedz Noteikumos Nr.57 minētos trīs mēnešus no paziņojuma brīža un pēc šī termiņa tiks nodrošināts iepakojuma marķējums un lietošanas instrukcija valsts valodā, piemēram, zāles pārpakojot;
- Latvijas tirgū nav pieejamas citas Latvijas zāļu reģistrā un kompensējamo zāļu sarakstā (A, B un C saraksts) iekļautas zāles ar tādu pašu aktīvo vielu, stiprumu un zāļu formu;
- gadījumā, ja paziņojumu ZVA reģistrācijas apliecības īpašnieka vietā nosūta pārstāvis, ka ZVA ir iesniegta atbilstoša pilnvara.
Paziņojuma iesniegšanai ZVA aicinām izmantot tiešsaistes paziņošanas formu
Saņemot paziņojumu, ZVA pārbauda sniegtās informācijas atbilstību Noteikumu Nr.57 prasībām. Konstatējot neatbilstības, komersants tiek par to informēts. Savukārt gadījumos, kad saņemtā informācija ir atbilstoša, tā ir pieņemta un komersants ir tiesīgs uzsākt paziņojumā norādīto zāļu izplatīšanu, ZVA trīs darba dienu laikā no paziņojuma saņemšanas savā tīmekļvietnē publicē paziņojumā ietverto informāciju.
ZVA atļaujas citas valsts tirgum paredzēto zāļu izplatīšanai
Citos gadījumos, kad neizpildās iepriekš aprakstītie Noteikumos Nr.57 noteikti kritēriji par paziņojumiem, ko sniedz reģistrācijas apliecības īpašnieks ZVA attiecībā uz zāļu izplatīšanu citas valsts tirgum paredzētajos gadījumos (piemēram, izplatīšana aptiekām citas ES/EEZ valsts tirgum paredzētā ilgāk par trīs mēnešiem), zāļu izplatīšana citas valsts tirgum paredzētajos iepakojumos ir iespējama tikai pēc attiecīgas ZVA atļaujas saņemšanas.
Saraksts ar zālēm, par kurām pamatojoties uz Noteikumu Nr. 57 6.3. un 7.6 apakšpunktu ZVA saņēmusi reģistrācijas apliecības īpašnieku sniegtos paziņojumus vai kurām ZVA izsniegusi atļauju zāļu izplatīšanai citas valsts tirgum paredzētā iepakojumā pieejams šeit.













