Zāļu valsts aģentūra sagatavojusi infografikas par patentbrīvo un oriģinālo zāļu patēriņu, kas liecina, ka pērn trīs no katriem četriem Latvijā pārdotajiem zāļu iepakojumiem ir bijušas patentbrīvās zāles.
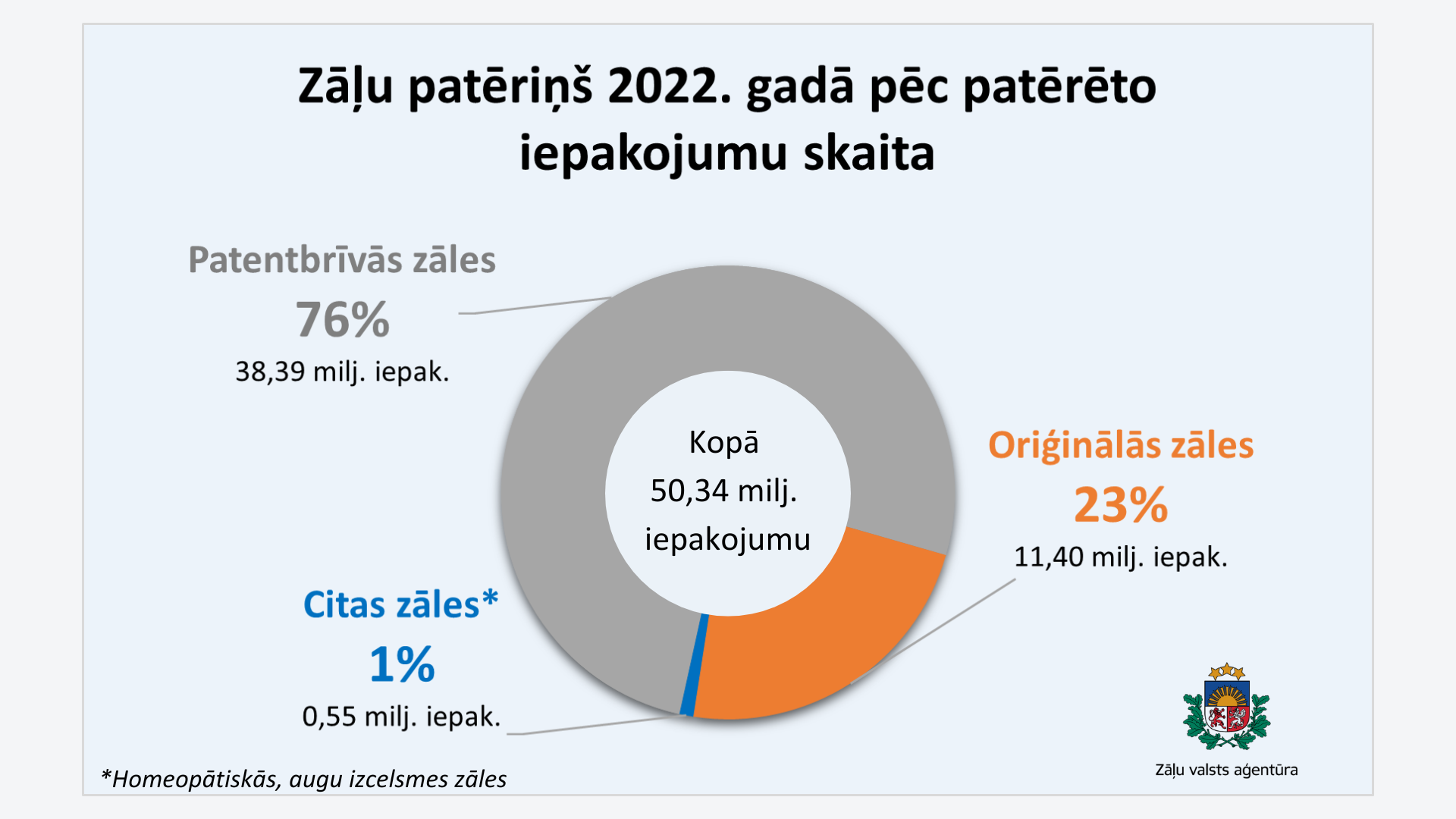
2022. gadā Latvijā patērēti aptuveni 38 miljoni patentbrīvo jeb ģenērisko zāļu iepakojumu (76%) un 11 miljoni oriģinālo zāļu iepakojumu (23%). Pārējo zāļu patēriņu veidoja homeopātiskās, augu izcelsmes un citas zāles (1%). 2021. un 2020. gadā arī patentbrīvo zāļu patēriņš bija 76% no realizēto iepakojuma skaita. Savukārt 2019. gadā šo zāļu patēriņš bija 74% no realizēto iepakojuma skaita.
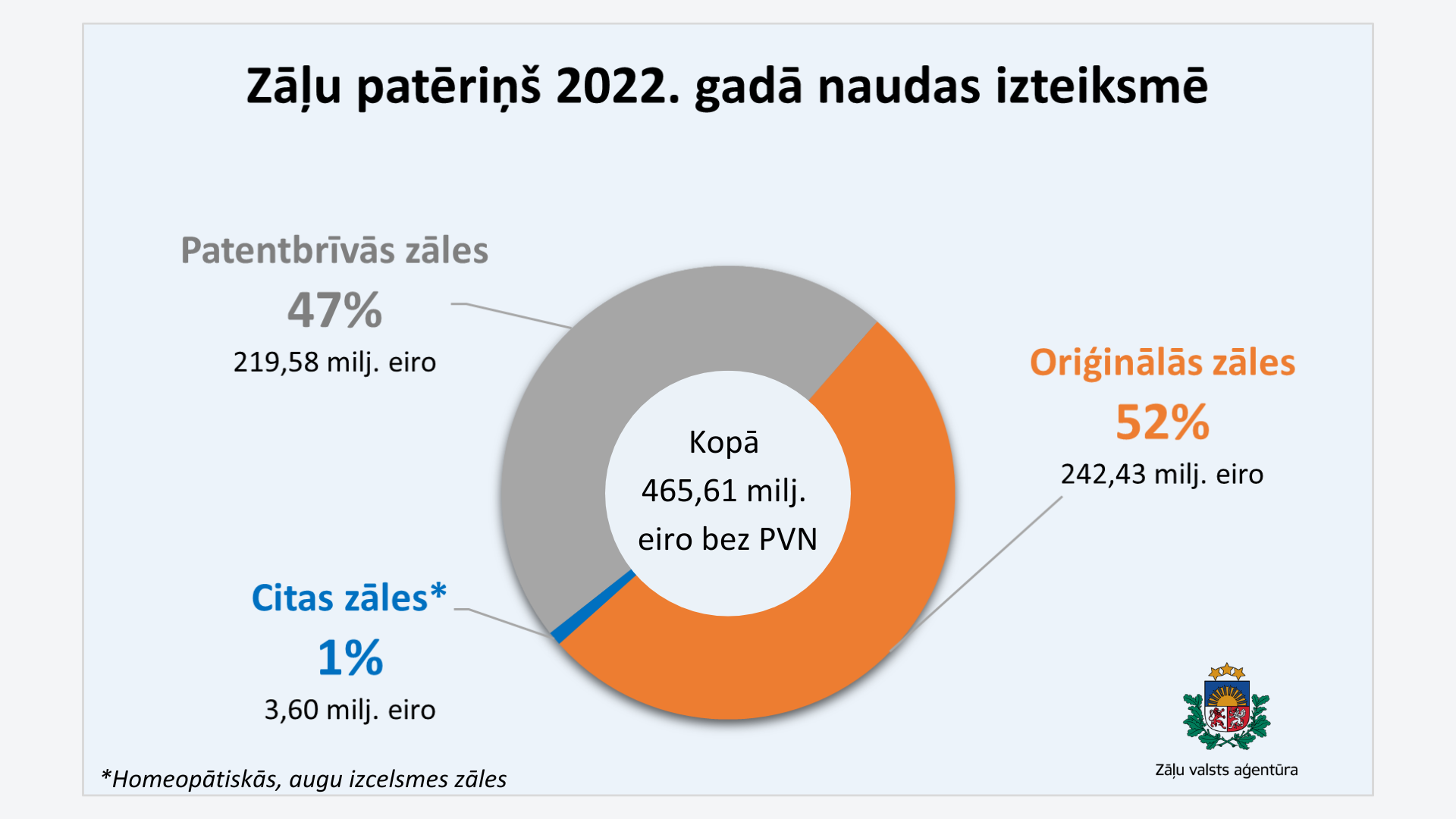
Patentbrīvās zāles pagājušajā gadā veidoja 47% no kopējā zāļu apgrozījuma eiro, 2021. gadā – 46%, 2020. gadā – 45%, savukārt 2019. gadā – 44% no kopējā zāļu apgrozījuma naudas izteiksmē (eiro). Šie dati liecina, ka patentbrīvo zāļu patēriņam Latvijā ir tendence pieaugt.
Oriģinālo zāļu analogi ir patentbrīvās zāles. Šīs zāles satur to pašu aktīvo vielu (galveno zāļu sastāvdaļu, kas nodrošina ārstēšanu) tādā pašā daudzumā kā oriģinālās zāles. Patentbrīvās zāles lieto tādu pašu slimību ārstēšanai kā oriģinālās zāles. Šīs zāles ir tikpat drošas un kvalitatīvas, bet šo zāļu izskats un iepakojums var atšķirties.
Svarīgi minēt, ka patentbrīvās zāles drīkst reģistrēt tikai tad, kad oriģinālām zālēm ir beidzies ražotāja pieteiktais datu aizsardzības darbības laiks - proti, ne mazāk kā pēc 10 gadiem kopš oriģinālo zāļu reģistrēšanas. Līdz ar to šīs zāles jau ir atradušās tirgū un pacienti tās ir lietojuši jau vismaz šādu laika periodu.
Lai šādas patentbrīvas zāles tiktu reģistrētas un nonāktu tirgū, bioekvivalences pētījumos jāpierāda, ka, lietojot patentbrīvās zāles vai oriģinālās zāles vienādā devā noteiktu periodu, cilvēka organismā nokļūst tāds pats aktīvās vielas daudzums.
Zāļu aģentūras rūpīgi izvērtē visus datus par zālēm un to ražošanas procesu gan pirms zāļu reģistrēšanas, gan to pēcreģistrācijas laikā neatkarīgi no tā, vai zāles ir oriģinālas vai patentbrīvas. Eksperti vērtē visu – sākot no visām zāļu sastāvā esošām vielām līdz iepakojumam. Ja prasības tiek izpildītas, tikai tad zāles tiek reģistrētas un nonāk tirgū. Savukārt pēc zāļu reģistrācijas visām zālēm vienādi tiek uzraudzītas blakusparādības.
Vairāk informācijas par zāļu statistiku un salīdzinājums ar iepriekšējiem gadiem ir pieejams šeit.
Infografiku informācijas avots: zāļu lieltirgotavu sniegtie ikmēneša realizācijas pārskati (nav iekļauta informācija par zālēm, ko viena lieltirgotava izplata citai)













