Zāles pret Covid-19 lietošanai visā Eiropas Savienībā (ES), arī Latvijā, reģistrē jeb apstiprina Eiropas Komisija (EK) pēc Eiropas Zāļu aģentūras (EZA) izsniegtas rekomendācijas šo zāļu reģistrēšanai.
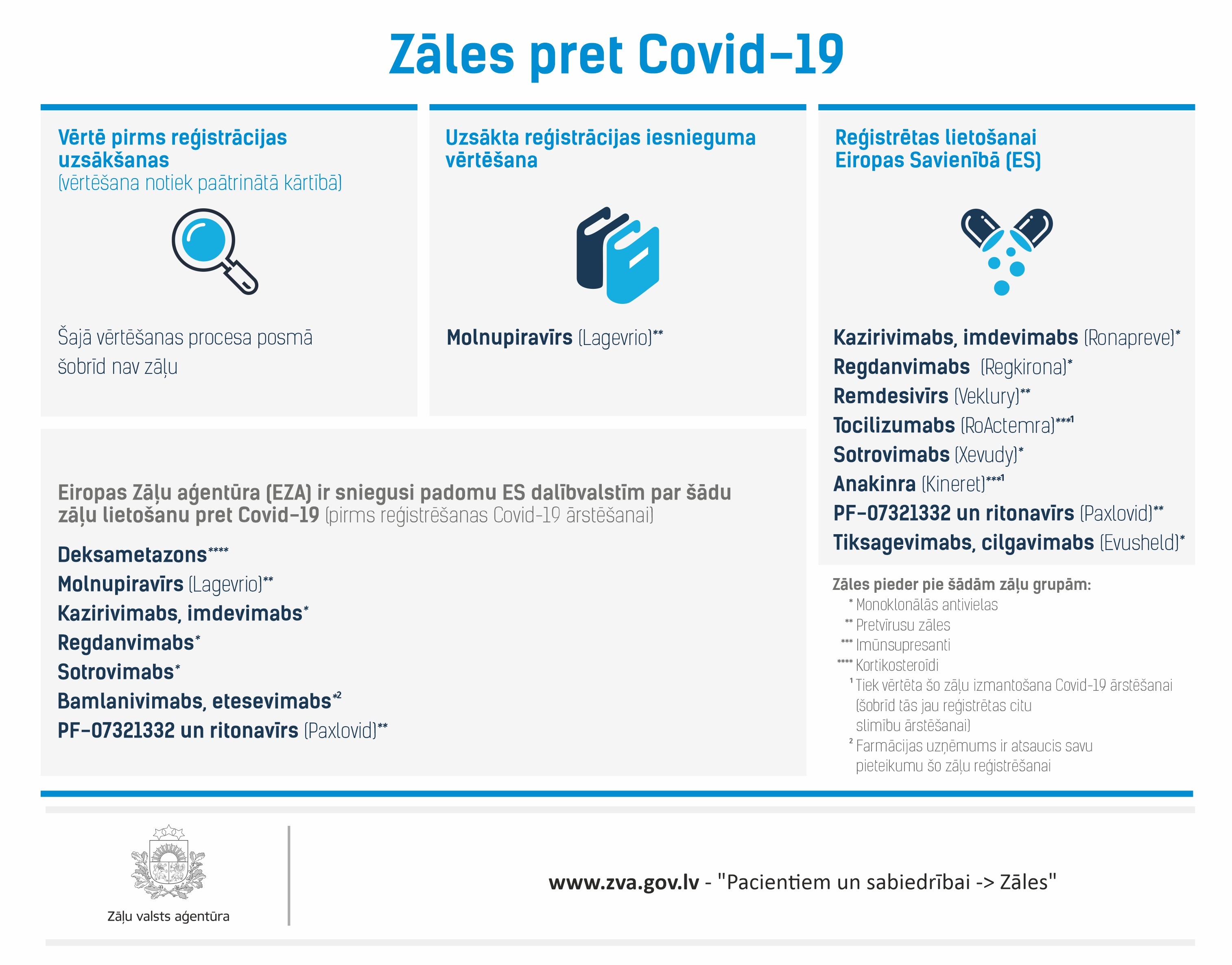
Reģistrētas zāles lietošanai ES:
- Remdesivīrs (Veklury)
- Regdanvimabs (Regkirona)
- Kazirivimabs, imdevimabs (Ronapreve)
- Tocilizumabs (RoActerma)
- Sotrovimabs (Xevudy)
- Anakinra (Kineret)1
- Tiksagevimabs, cilgavimabs (Evushed)
- PF 07321332 / ritonavīrs (Paxlovid)
Šobrīd ES ir reģistrētas 8 zāles Covid-19 ārstēšanai. No tām 2 ir pretvīrusu zāles (remdesivīrs un PF 07321332/ritonavīrs), 4 monoklonālās antivielas – regdanvimabs, kasirivimaba un imdevimaba kombinācija, sotrovimabs, tiksagevimaba un cilgavimaba kombinācija, kā arī 2 imūnsupresīvas zāles (šīs zāles samazina imūnās sistēmas aktivitāti) - tocilizumabs un anakinra.
Remdesivīrs ir paredzēts lietošanai slimnīcās pacientiem, kuriem ir smaga slimības norise. Šīs zāles tika reģistrētas pērn un Latvijā tās lieto Covid-19 ārstēšanai tikai slimnīcās. Savukārt 2021. gada 12. novembrī EK apstiprināja divas monoklonālo antivielu* grupas zāles Ronapreve (kasirivimaba un imdevimaba kombināciju) un Regkirona (regdanvimabu). 2021. gada 16. decembrī vēl divas zāles - monoklonālās antivielas sotrovimabu un imūnsupresīvas zāles ar aktīvo vielu anakinra.
Plašai sabiedrībai aptiekā nopērkamas zāles pret Covid-19 nav reģistrētas.
Vairāk informācijas par reģistrētajām zālēm
Remdesivīrs
Remdesivīrs ir pirmās zāles ES, kas ir apstiprinātas Covid-19 ārstēšanai (zāles tika apstiprinātas 2020. gada jūlijā). Šīs zāles ir paredzētas Covid-19 ārstēšanai pieaugušiem un bērniem sākot no 12 gadu vecuma, ja viņiem radusies pneimonija un nepieciešama papildu skābekļa pievade, t.i., pacientiem ar smagu slimības gaitu. Šīs zāles tiek ievadītas vēnā infūzijas (pilienu) veidā vai injicējot zem ādas. To lietošana ir atļauta tikai veselības aprūpes iestādēs, kurās iespējama rūpīga pacientu uzraudzība. Plašāk par šīm zālēm lasiet šeit.
Ronapreve (kasirivimaba un imdevimaba kombinācija) un Regkirona (regdanvimabs)
- EZA ir ieteikusi reģistrēt Ronapreve Covid-19 ārstēšanai pieaugušajiem un pusaudžiem no 12 gadu vecuma ar vismaz 40 kg lielu ķermeņa masu, kuriem nav nepieciešams papildu skābeklis un kuriem ir paaugstināts risks smagai slimības norisei. Ronapreve ir lietojams arī Covid-19 profilaksei personām no 12 gadu vecuma ar vismaz 40 kg lielu ķermeņa masu. Ronapreve reģistrācijas pieteicējs ir uzņēmums Roche Registration GmbH.
- Savukārt zāles Regkirona EZA ir ieteikusi reģistrēt Covid-19 ārstēšanai pieaugušajiem, kuriem nav nepieciešams papildu skābeklis un kuriem ir paaugstināts risks smagai slimības norisei. Regkirona reģistrācijas pieteicējs ir uzņēmums Celltrion Healthcare Hungary Kft.
Ronapreve un Regkirona ir pirmās monoklonālo antivielu grupas zāles. Monoklonālās antivielas ir olbaltumvielas, kas izstrādātas, lai piesaistītos specifiskām mērķstruktūrām, šajā gadījumā – SARS-CoV-2 vīrusa pīķa proteīnam, ko vīruss izmanto iekļūšanai cilvēka šūnās.
EZA ir izvērtējusi pētījumu datus, kas liecina, ka ārstēšana ar Ronapreve vai Regkirona būtiski mazina hospitalizāciju un nāvi Covid-19 slimniekiem, kuriem ir paaugstināts risks smagai slimības norisei. Vēl vienā pētījumā ir novērots, ka Ronapreve samazina Covid-19 iespējamību, ja kāds no mājsaimniecības ir inficējies ar SARS‐CoV‐2, vīrusu, kas izraisa Covid-19 slimību.
Regkirona tiek ievadītas vēnā infūzijas (pilienu) veidā vai injicējot zem ādas. Ronapreve tiek ievadītas tikai vēnā infūzijas (pilienu) veidā. To lietošana ir atļauta tikai slimnīcās vai citās veselības aprūpes iestādēs, kurās iespējama rūpīga pacientu uzraudzība.
Šo zāļu reģistrācijas pieteikumu vērtēšanas laikā EZA ir sniegusi ieteikumus ES dalībvalstīm, lai palīdzētu lemt par šo zāļu agrīnu izmantošanu. Tas nozīmē, ka šīs zāles dažiem pacientiem ES jau ir bijušas pieejamas.
EZA savus 2021. gada 11. novembrī sniegtos ieteikumus abas šīs zāles reģistrēt nosūtīja EK ātrai visām ES dalībvalstīm juridiski saistoša lēmuma pieņemšanai, un EK 12. novembrī pieņēma lēmumu par šo zāļu apstiprināšanu lietošanai visā ES. Plašāk lasiet šeit.
Uzsākta reģistrācijas pieteikuma vērtēšana
EZA šobrīd izvērtē 1 pretvīrusu zāļu - "Lagevrio", kuru aktīvā viela ir molnupiravīrs - lietošanu pret Covid-19.
Zāles, ko EZA šobrīd vērtē pirms reģistrācijas uzsākšanas (vērtēšana notiek paātrinātā kārtībā)
Šajā vērtēšanas procesa posmā šobrīd zāļu nav.
EZA ir sniegusi padomu ES dalībvalstīm par šādu Covid-19 ārstēšanai paredzētu zāļu lietošanu pirms to oficiālas reģistrēšanas:
- Deksametazons
- Molnupiravīrs (Lagevrio)
- Kazirivimabs, imdevimabs
- Regdanvimabs
- Sotrovimabs
- Bamlanivimabs, etesevimabs**
- PF-07321332 un ritonavīra (Paxlovid)
EZA ir sniegusi padomu ES dalībvalstīm par 7 zāļu lietošanu pret Covid-19 pirms to apstiprināšanas Covid-19 ārstēšanai (no tām 4 ir monoklonālās antivielas, 2 - pretvīrusu zāles un 1 zāles, kuras pieder zāļu grupai, ko sauc par kortikosteroīdiem). Sniegtie padomi ir balstīti uz veiktajiem pētījumiem un tajā brīdī pieejamajiem datiem, kas apliecina šo zāļu drošumu, iedarbīgumu un kvalitāti.
Zāles pret Covid-19 EZA vērtē un iesaka reģistrācijai tādā procedūrā, kas tika izmantota arī piecu ES lietošanai apstiprināto Covid-19 vakcīnu vērtēšanas un reģistrācijas gadījumā.
Zāles pret Covid–19, ko šobrīd izvērtē EZA vai kas ir reģistrētas ES, nevar aizstāt vakcināciju. Vakcinācija ir efektīvākais veids, kā pasargāt cilvēkus no infekcijas slimībām.
Zāles pieder pie šādām zāļu grupām:
Imūnsupresanti (vielas, kas kavē vai stimulē imūnreakciju) – baricitinibs, anakinra, tocilizumabs
Kortikosteroīdi – deksametazons
Monoklonālās antivielas – regdanvimabs, kazirivimaba un imdevimaba kombinācija, bamlanivimaba un etesevimaba kombinācija, sotrovimabs, tiksagevimaba un cilgavimaba kombinācija
Pretvīrusu zāles – remdesivīrs, molnupiravīrs, PF-07321332 un ritonavīra kombinācija
* Monoklonālās antivielas ir specifiskas olbaltumvielas, kas izstrādātas tā, lai atpazītu noteiktu struktūru, ko sauc par antigēnu, un tai piesaistītos. Monoklonālās antivielas, kas ir paredzētas Covid-19 slimības gadījumā, ir izveidotas tā, lai saistītos ar Covid-19 izraisošā vīrusa SARS-CoV-2 pīķa proteīnu. Kad šīs zāles ir saistījušās ar pīķa proteīnu, vīruss nespēj iekļūt cilvēka organisma šūnās.
**Farmācijas uzņēmums ir atsaucis pieteikumu šo zāļu reģistrēšanai.
Informācija par vērtēšanas un reģistrācijas procesu
EZA izvērtē datus par zālēm pret Covid-19īsā laikā paātrinātas vērtēšanas procedūras ietvaros. Šo pieeju EZA izmanto ārkārtas situācijās saistībā ar sabiedrības veselību, lai izvērtētu datus, tiklīdz tie kļūst pieejami.
Precīzu vērtēšanas ilgumu līdz zāļu reģistrēšanai nevar noteikt, jo tas ir atkarīgs no uzņēmumu iesniegto datu kvalitātes. Tomēr šim procesam būtu jāizņem mazāk laika nekā ierastā vērtēšanā, pateicoties paātrinātās vērtēšanas sniegtajam laika ietaupījumam.
Paātrinātā vērtēšana
Paātrinātā vērtēšana ir viens no EZA rīkiem, kas ir noteikts normatīvos aktos, lai paātrinātu daudzsološu zāļu, tai skaitā arī vakcīnu, vērtēšanu sabiedrības veselības ārkārtas situācijās, piemēram, Covid-19 pandēmijas laikā.
Pateicoties paātrinātajai vērtēšanas procedūrai zāļu reģistrēšana var tikt pabeigta aptuveni 70 dienu laikā, salīdzinot ar parasto reģistrēšanas veikšanas praksi, kas notiek 210 dienas.
Parasti uzņēmumam, kas vēlas zāles reģistrēt, visi dati par zāļu iedarbību, drošumu un kvalitāti (tai skaitā ražošanu), kā arī visi nepieciešamie dokumenti zāļu reģistrācijai EZA jāiesniedz oficiāla pieteikuma veidā pirms vērtēšanas sākšanas. Paātrinātās vērtēšanas gadījumā EZA Zāļu reģistrācijas komiteja izvērtē datus no tajā brīdī notiekošiem pētījumiem, jo farmācijas uzņēmums tos iesniedz vērtēšanai EZA pa daļām, tiklīdz tie kļūst pieejami.
Šos datus EZA vērtē tā saucamajos “paātrinātās vērtēšanas ciklos” – ciklu skaits nav iepriekš noteikts, jo vērtēšanas procesu nosaka uzņēmuma iesniegto datu pieejamība.
Kad EZA pieņem lēmumu, ka ir pieejams pietiekams datu apjoms, farmācijas uzņēmums var iesniegt EZA oficiālu pieteikumu zāļu reģistrācijai. Izvērtējot datus, tiklīdz tie kļūst pieejami, EZA var ātrāk sniegt atzinumu par zāļu reģistrāciju, jo daļu datu EZA jau ir izvērtējusi paātrinātas vērtēšanas laikā.
Zāļu reģistrācija ar nosacījumiem
Zāles Covid-19 ārstēšanai un profilaksei EZA iesaka reģistrācijai ar nosacījumiem. Tas ir viens no ES reglamentējošiem mehānismiem, kura mērķis ir veicināt ātrāku piekļuvi zālēm, kas apmierina iepriekš neatbildētas medicīniskas vajadzības, tostarp ārkārtas situācijās, kad pastāv tādi draudi sabiedrības veselībai kā pašreizējās pandēmijas laikā.
Šāda zāļu apstiprināšana ļauj EZA ieteikt zāles reģistrācijas apliecības izsniegšanai, pamatojoties uz pieejamiem datiem, ja šo zāļu tūlītējas pieejamības sniegtie ieguvumi pacientiem pārsniedz risku saistībā ar faktu, ka vēl nav pieejami visi dati.
Uzņēmumiem pēc šo zāļu reģistrācijas ir jāizpilda vairāki nosacījumi, tādi kā jāsniedz EZA šo zāļu pētījumu gala ziņojumi un papildu dati par zāļu kvalitāti. Tāpat kā visām zālēm, šo zāļu riska pārvaldības plāns nodrošinās rūpīgu to drošuma uzraudzību pēc reģistrācijas visā ES. Turpmāk tiks iegūti papildu dati, tai skaitā no pēcreģistrācijas ziņojumiem, un tos regulāri izvērtēs EZA Zāļu reģistrācijas komiteja (CHMP) un Drošuma komiteja (PRAC). Tiks sniegti arī ikmēneša drošuma ziņojumi.
Zāles, tai skaitā arī vakcīnas, pret Covid-19 tiek reģistrētas tikai tad, ja EZA saņem uzticamus un pārliecinošus zinātniskus pierādījumus, ka to ieguvums daudzkārt pārsniedz riskus. Zālēm, un arī vakcīnām, jāatbilst Eiropā pastāvošajām stingrajām prasībām efektivitātei, drošumam un kvalitātei, tai skaitā EZA apstiprina veidu, kā zāles tiek ražotas, un pārliecinās par to, ka ražotnes atbilst augstiem ražošanas standartiem.
Reģistrācijas prasības nekādā mērā netiek atvieglotas Covid-19 zāļu vai vakcīnu reģistrācijai, reģistrācijai, laika ietaupījums ir balstīts uz pierādījumu vērtēšanu, tiklīdz pētījumi tiek noslēgti un nekavējoties iesniegti pārbaudei EZA.
Pandēmijas laikā EZA un tās zinātniskajai komitejai atbalstu sniedz arī Covid-19 EZA pandēmijas darba grupa (COVID-ETF). Tajā darbojas eksperti no Eiropas valstu zāļu aģentūrām, kuri sniedz konsultācijas par zāļu un vakcīnu pret Covid-19 izstrādi, reģistrāciju un drošuma uzraudzību, kā arī nodrošina ātru un koordinētu iestāžu darbu.
EZA cieši sadarbojas ar Eiropas Komisiju, lai paātrinātu lēmuma pieņemšanu par reģistrācijas apliecības piešķiršanu visās ES un EEZ dalībvalstīs, tādējādi atļaujot zāļu tirdzniecību ES.
Informācija atjaunināta: 20.04.2023.













