Zāļu valsts aģentūra (ZVA) informē, ka tāpat kā pēc visu vakcīnu un jebkuru zāļu lietošanas, arī pēc Covid-19 vakcīnu saņemšanas, var tikt novērotas blakusparādības jeb blaknes, bet ne visi cilvēki ar tām saskaras. Tomēr ir ļoti būtiski, ka blakusparādību, ko rada vakcīna, nav vairāk un tās nav smagākas kā Covid-19 simptomi un pati slimība, no kuras šīs vakcīnas pasargā. Informācija par visām vakcīnu apstiprinātajām blakusparādībām ir pieejama lietošanas instrukcijā.
Pielāgoto Covid-19 vakcīnu "Comirnaty" (Pfizer-BioNTech) un "Spikevax" (Moderna) blakusparādības ir līdzīgas blakusparādībām, kas tika novērotas oriģinālajām vakcīnām.
Lietošanas instrukcijas – iepazīsties ar pilnu informāciju par visām vakcīnu apstiprinātām blakusparādībām
|
Statistika par Latvijā saņemtajiem ziņojumiem par Covid-19 vakcīnu blakusparādībām (dati atjaunināti: 14.07.2023.)
Šajā sadaļā ZVA publicē aktuālo informāciju par Latvijā saņemtajiem Covid-19 vakcīnu iespējamu blakusparādību ziņojumiem. Bet tas nenozīmē, ka visos gadījumos ziņotie veselības traucējumi ir obligāti saistīti ar zāļu lietošanu, proti, ka ir apstiprināta blakusparādība.
Kopš vakcinācijas pret Covid-19 sākuma līdz 2023. gada 14. jūlijam Latvijā ir saņemti 3514 ziņojumi par Covid-19 vakcīnu iespējamām blakusparādībām.
Līdz šim laikam vakcinācija ar kādu no vakcīnām pret Covid-19 Latvijā ir veikta vairāk nekā 2,86 milj. reižu (skat. Nacionālā veselības dienesta datus par precīzu savakcinēto devu skaitu).
Statistikas dati liecina, ka par blakusparādībām ir ziņojis 1 cilvēks no katriem 800 veikto vakcinācijas reižu.
Aptuveni 24 % ziņojumu ir iesnieguši ārsti un 76 % ziņojumu iesnieguši pacienti.
Visbiežāk Latvijā ziņotās blakusparādības
Visbiežāk ZVA saņemti ziņojumi par Covid-19 vakcīnu lietošanas instrukcijās norādītām organisma reakcijām, piemēram, par sāpēm vakcīnas injekcijas vietā, paaugstinātu ķermeņa temperatūru, drebuļiem un nogurumu.
Pfizer-BioNTech izstrādātajai vakcīnai “Comirnaty” un Moderna vakcīnai “Spikevax” biežāk ziņots par blakusparādībām pēc otrās devas. Savukārt AstraZeneca vakcīnas (“Vaxzevria”) un Janssen vakcīnas (“Jcovden") saņemšanas gadījumā vairāk cilvēku biežāk blakusparādības novēroja pēc pirmās devas.
Minētie simptomi parasti rodas 8-10 stundu laikā pēc vakcinācijas un parasti izzūd 2 – 3 dienu laikā.
Saņemto blakusparādību ziņojumu skaits sadalījumā pa vakcīnu veidiem (kopā šajā sadalījumā ir ir ietverti 3500 ziņojumi, kas ZVA tika saņemti līdz 2023. gada 1. janvārim)
| Comirnaty (Pfizer/BioNTech) | |||||
| 1.deva | 2. deva | Balstvakcinācija | Comirnaty Original/Omicron BA.1 | Comirnaty Original/Omicron BA.4-5 | Comirnaty kopā |
| 616 | 894 | 127 | 6 | 2 | 1645 |
| Spikevax (Moderna) | |||||
| 1. deva | 2. deva | Balstvakcinācija | Spikevax bivalent Original/Omicron BA.1 | Spikevax kopā | |
| 235 | 250 | 174 | 1 | 660 | |
| Vaxzevria (AstraZeneca) | |||||
| 1. deva | 2. deva | Balstvakcinācija | Vaxzevria kopā | ||
| 700 | 73 | 0 | 773 | ||
| Jcovden (Janssen) | |||||
| 1. deva | Balstvakcinācija | Jcovden kopā | |||
| 422 | 0 | 422 | |||
Augstāk esošajās tabulās ir norādīta informācija par blakusparādību ziņojumu skaitu katrai no Covid-19 vakcīnām, par kurām ir ziņots par blakusparādībām.
Būtiskie blakusparādību ziņojumi
No visiem līdz 2023. gada 14. jūlijam saņemtajiem ziņojumiem 833 ziņojumi (jeb 23 % no visiem saņemtajiem blakusparādību ziņojumiem) klasificēti kā būtiski* ziņojumi. Šāds apzīmējums “būtisks” visā ES tiek izmantots, lai ziņojumus prioritārā kārtībā ievadītu Eiropas Zāļu aģentūras (EZA) ES vienotajā blakusparādību ziņojumu datubāzē, un tādējādi EZA ātrāk varētu izvērtēt ES/EEZ saņemtos ziņojumus par blakusparādībām. Informējam, ka iesniegtajā blakusparādību ziņojumā norādītos veselības traucējumus un reakciju atbilstību būtiskuma kritērijiem var noteikt tikai, veicot ziņojuma vērtējumu.
Papildu informācija:
ZVA, tāpat kā visu pārējo ES dalībvalstu zāļu aģentūrās, saņemtie iespējamu blakusparādību ziņojumi tiek iedalīti divās kategorijās:
1) ziņojumi par iespējamām būtiskām blakusparādībām un
2) ziņojumi par iespējamām mazāk būtiskām blakusparādībām, bet tas nenozīmē, ka visos gadījumos ziņotie veselības traucējumi ir obligāti saistīti ar zāļu lietošanu, proti, ka ir apstiprināta blakusparādība.
*Būtiska zāļu blakusparādība ir tāda, kas:
- rada nepieciešamību pacientu hospitalizēt vai paildzināt esošo hospitalizāciju;
- izraisa paliekošu vai būtisku darbnespēju vai invaliditāti;
- ir dzīvībai bīstama;
- izraisa nāvi;
- ir iedzimts defekts;
- ir medicīniski būtiska (blakusparādība neatbilst nevienam no iepriekš minētiem kritērijiem, bet ārsts to uzskata par medicīniski būtisku, vai citi medicīniski nozīmīgi notikumi, kam bija nepieciešama medicīniska iejaukšanās).
Savukārt mazāk būtiskas ir visas citas zāļu blakusparādības, kas neatbilst būtisku blakusparādību kritērijiem.
Zāļu valsts aģentūrā līdz 2023. gada 14. jūlijam saņemtie Covid-19 vakcīnu iespējamu blakusparādību ziņojumi par īpašās intereses nevēlamiem notikumiem (AESI), kurus uzrauga īpaši rūpīgi (lūdzu, skat. tabulu)
Īpašās intereses notikums | Saņemto ziņojumu skaits |
Miokardīts (Daži no ziņotajiem miokardītiem ir mioperikardīti (miokardīts + perikardīts), kas ir ierasti, ņemot vērā slimības patoģenēzi) | 26 ziņojumi |
Perikardīts | 2 ziņojumi |
Sejas paralīze (nav saņemti ziņojumi par pilnīgu sejas paralīzi, bet ir saņemti atsevišķi ziņojumi par vienpusēju, dažādas pakāpes sejas muskulatūras parēzi) | 10 ziņojumi
|
Tromboze ar trombocitopēniju | 1 ziņojums |
Trombocitopēnija | 6 ziņojumi |
Imūna trombocitopēnija | 2 ziņojumi |
Venoza trombembolija | 28 ziņojumi |
Gijēna-Barē sindroms (GBS) | 8 ziņojumi |
Anafilakse | 15 ziņojumi |
Multisistēmu iekaisuma sindroms | 1 ziņojums |
Dažādas pakāpes ožas un garšas zudums | 12 ziņojumi |
Autoimūns encefalīts | 2 ziņojumi |
Akūts pankreatīts | 1 ziņojums |
Akūts nieru bojājums | 1 ziņojums |
Rabdomiolīze | 1 ziņojums |
Sensorineirāls dzirdes zudums | 1 ziņojums |
Akūts diseminēts encefalomielīts (ADEM) | 2 ziņojumi |
Informācija par Latvijā ziņotajiem letālajiem gadījumiem
Līdz 2023. gada 14. jūlijam ZVA ir saņēmusi un izvērtējusi 59 Covid-19 vakcīnu blakusparādību ziņojumus, kuros sniegta informācija par letāliem gadījumiem, kas ir notikuši vairāku dienu vai vairāku mēnešu laikā pēc vakcinācijas. No tiem 58 gadījumos nav apstiprināta saistība ar vakcināciju pret Covid-19, viens letāls gadījums ir ticami saistāms ar vakcīnas "Vaxzevria" (iepriekš zināma kā "Covid-19 vakcīna AstraZeneca") lietošanu.
Izvērtējot ziņoto gadījumu, ZVA secinājusi, ka patologanatomiskā ekspertīzē konstatēto pārmaiņu cēloniskais sakars ar vakcīnas "Vaxzevria" lietošanu ir vērtējams kā ticams, un šai gadījumā ir konstatēta iespējama vakcīnas "Vaxzevria" ļoti reti sastopama blakusparādība - trombozes un trombocitopēnijas sindroms (TTS).
TTS ir ļoti retos gadījumos novērota blakusparādība tikai vīrusa vektora vakcīnām ("Vaxzevria" un "Covid-19 Vaccine Janssen"), kas dažos gadījumos noris kopā ar asiņošanu un visbiežāk rodas trīs nedēļu laikā pēc vakcinācijas. TTS ir iekļauts šo vakcīnu lietošanas instrukcijā un zāļu aprakstā. Savukārt ne Pfizer-BioNTech vakcīnai "Comirnaty", ne Moderna vakcīnai "Spikevax" (abas ir mRNS jeb ziņneša vakcīnas) TTS nav iekļauts blakusparādību sarakstā.
TTS ir būtiski atšķirīgs klīnisks stāvoklis no medicīnā visai bieži sastopamām trombozēm un vienmēr ietver vienlaikus esošu trombocitopēniju (jeb samazinātu trombocītu skaitu asinīs). Medicīnā visai bieži sastopamā tromboze bez vienlaikus esošas trombocitopēnijas nav tas pats, kas vakcīnas Vaxzevria blakusparādība TTS.
ZVA vērtēšanu veica, balstoties uz zinātniskām metodēm un prasībām, kas ir vienādas visā Eiropas Savienībā (ES), atbilstoši Pasaules Veselības organizācijas (PVO) izstrādātiem zāļu drošuma uzraudzības (jeb farmakovigilances) standartizētiem cēloniskā sakara vērtēšanas kritērijiem.
Ikmēneša drošuma pārskati par Covid-19 vakcīnām ar jaunāko informāciju par ES izvērtētajām blakusparādībām
Dati par vakcīnas lietošanu un drošumu tiek pastāvīgi uzraudzīti, un sabiedrībai tiek regulāri sniegta jaunākā vakcīnas drošuma informācija.
Saskaņā ar ES izstrādāto nepārtrauktas Covid-19 vakcīnu drošuma uzraudzības plānu, šo vakcīnu uzraudzība tiek veikta ievērojami intensīvāk nekā citām zālēm, lai nodrošinātu jaunas drošuma informācijas ātru identificēšanu, apkopošanu un analīzi. Uzņēmumam, kurš vakcīnas ir reģistrējis, vienu reizi mēnesī jāiesniedz Eiropas Zāļu aģentūrā (EZA) drošuma pārskats par saņemtiem blakusparādību ziņojumiem.
Šajā sadaļā aicinām iepazīties ar aktuālo pārskatu par Covid-19 vakcīnu drošumu. Katras vakcīnas Drošuma pārskatā iekļautā informācija pieejama latviešu valodā un tiek atjaunota vienu reizi mēnesī.
Drošuma pārskatos apkopoti EZA Zāļu drošuma komitejas veiktās jaunākās drošuma datu vērtēšanas rezultāti no visas pasaules. Tajos ietverta arī informācija no ziņojumiem par iespējamām blakusparādībām, kuru EZA ņem vērā, veicot vērtēšanu.
- Jaunākā drošuma informācija par Covid-19 vakcīnām (publicēta 2022. gada 13. decembrī)
Šie un citi pasākumi arī ļaus normatīvā regulējuma iestādēm ātri izvērtēt jaunākos datus no dažādiem informācijas avotiem un nepieciešamības gadījumā veikt visas nepieciešamās reglamentējošas darbības sabiedrības veselības aizsardzībai.
Informējam, ka līdz ar 2022. gada decembra ikmēneša drošuma pārskatu tiks noslēgta šo pārskatu publicēšana un veidošana
EZA norāda, ka Covid-19 vakcīnu plašais pielietojums ir ļāvis relatīvi īsā laikā iegūt lielu drošuma datu apjomu no spontānajiem ziņojumiem par blaknēm jeb blakusparādībām.
Kopš pirmo vakcīnu reģistrācijas 2020. gada decembrī EZA ir regulāri sniegusi informāciju speciālos ikmēneša drošuma pārskatos par PRAC veiktajām vērtēšanas procedūrām, kurās aplūkoti no šiem ziņojumiem, kā arī no citiem avotiem iegūtie dati. Pašlaik vairums ES iedzīvotāju ir saņēmuši vismaz vienu Covid-19 vakcīnu, un ar klīnisko un citu pētījumu, kā arī spontāno ziņojumu palīdzību ir noskaidrots šo vakcīnu drošuma profils. Tādēļ līdz ar 2022. gada decembra ikmēneša drošuma pārskatu tiks noslēgta šo pārskatu publicēšana.
Jaunākie drošuma dati par šīm vakcīnām, kā par jebkurām zālēm, joprojām tiks uzraudzīti un izvērtēti. Jauno reģistrēto vakcīnu reģistrācijas apliecību īpašnieki pirmos mēnešus pēc vakcīnu reģistrācijas turpinās iesniegt ikmēneša drošuma kopsavilkuma ziņojumus, lai veicinātu savlaicīgu guvuma un risku izvērtēšanu.
No 2023. gada janvāra informācija par būtiskām izmaiņām Covid-19 vakcīnu zāļu informācijā (lietošanas instrukcijā un zāļu aprakstā) tiks sniegta publikācijās par svarīgākajām atziņām no EZA Zāļu drošuma komitejas sanāksmēm. Nepieciešamības gadījumā var tikt sniegti arī speciāli sabiedrības veselības paziņojumi.
Informācija par katras vakcīnas zināmajām blaknēm ir iekļauta zāļu informācijā (lietošanas instrukcijā un zāļu aprakstā), kas pieejama Latvijas Zāļu reģistrā un EZA tīmekļvietnē visās ES/Eiropas Ekonomikas zonas (EEZ) valstu valodās. Informācija par iespējamu blakņu ziņojumiem joprojām ik mēnesi tiks atjaunināta EZA tīmekļa lapā par Covid-19 vakcīnu drošumu. Eiropas centralizētā datubāze par iespējamām zāļu blaknēm (EudraVigilance) joprojām tiks atjaunināta reizi nedēļā.
Kā rīkoties, ja saskaraties ar blakusparādībām?
Zāļu valsts aģentūra aicina pacientus vērsties pie sava ārsta, ja pēc vakcīnas saņemšanas rodas bažas par novērotajām blakusparādībām. Ārsta pienākums ir ziņot par konstatētām jebkuru zāļu, to vidū arī vakcīnu, izraisītām blakusparādībām Zāļu valsts aģentūrai.
Ikvienam pacientam Latvijā šobrīd ir radīta iespēja piedalīties zāļu, arī vakcīnu, drošuma uzraudzībā, iesniedzot ziņojumus par veselības traucējumiem, par kuriem viņam radušās bažas, ka tie, viņaprāt, varētu būt saistīti ar zāļu lietošanu. Ziņojumu var iesniegt elektroniski Zāļu valsts aģentūras tīmekļvietnē www.zva.gov.lv > “Ziņot par zāļu blaknēm, negadījumiem ar ierīcēm un biovigilanci”.
Kā notiek ziņojumu izvērtēšana un vakcīnu un jebkuru citu zāļu drošuma uzraudzība?
Zāļu valsts aģentūra (ZVA) ir sagatavojusi infografiku, lai sniegtu informāciju ikvienam iedzīvotājam un skaidrotu, kas notiek tālāk ar Latvijā saņemtajiem zāļu iespējamu blakusparādību ziņojumiem un kā notiek šo ziņojumu vērtēšana Eiropas Zāļu aģentūrā.
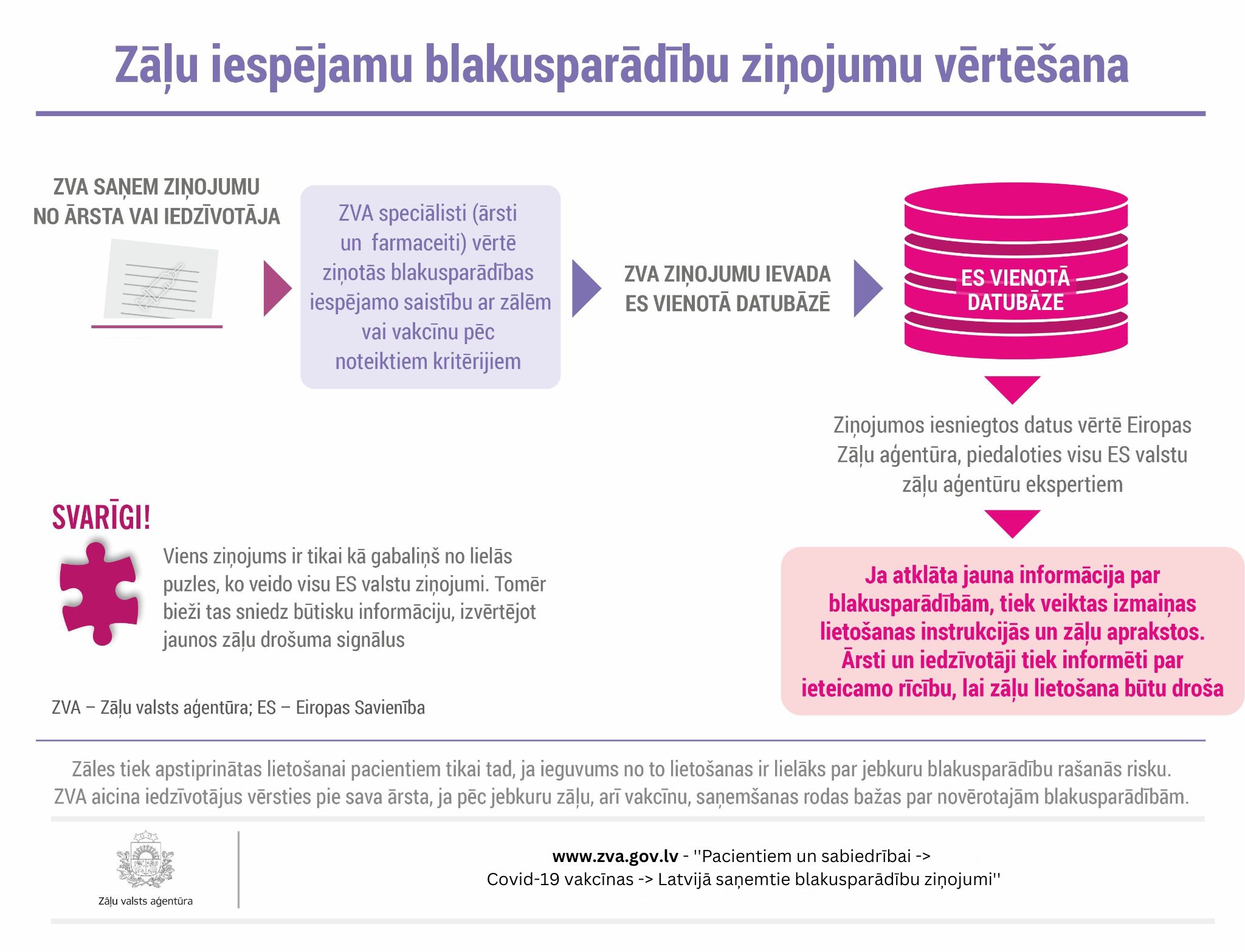
Video: Kā tiek nodrošināts, ka Covid-19 vakcīnas ir drošas lietošanai (uzzini, kas notiek ar Latvijā saņemtajiem blakusparādību ziņojumiem un kā tos vērtē Eiropas Zāļu aģentūrā)
- Ikvienu ZVA saņemto blakusparādību ziņojumu izvērtē ZVA eksperti, kas ir ārsti un farmaceiti.
- Vispirms eksperti pārbauda, vai ziņots par lietošanas instrukcijā norādītām blakusparādībām, un izvērtē ziņoto blakusparādību raksturu.
- Ja ziņots par būtiskām blakusparādībām, tad eksperti veic padziļinātu iesniegtā ziņojuma zinātnisku izvērtēšanu, vadoties pēc zinātniskiem principiem jeb metodikas cēloņsaistības noteikšanas algoritmiem.
- Ja nepieciešams, tad eksperti sazinās ar iesniegumā norādīto ārstu un/vai ziņojuma iesniedzēju, lai precizētu papildu informāciju, kas varētu būt nozīmīga ziņojuma izvērtēšanai, piemēram, informācija par citām vienlaikus lietotām zālēm, līdzšinējo veselības stāvokli, veiktajiem izmeklējumiem u.c.
- Ja nepieciešams, tad būtisku iespējamu blakusparādību izvērtēšanā tiek lūgts klīnisko ekspertu, Latvijas vadošo ārstu-speciālistu viedoklis.
- Visi Latvijā un ikvienā ES dalībvalstī saņemtie blakusparādību ziņojumi tiek ievadīti kopējā ES dalībvalstu blakusparādību ziņojumu datubāzē Eudravigilance.
- Kad šajā datubāzē par konkrētām zālēm vai aktīvo vielu uzkrājas vairāki ziņojumi par vienu un to pašu reakciju no visas ES, tiek identificēts statistisks zāļu drošuma signāls, kas tiek zinātniski izvērtēts EZA Drošuma komitejā, kurā strādā visu ES dalībvalstu zāļu aģentūru zāļu drošuma uzraudzības speciālisti. Eksperti kopīgi noskaidro ziņojumos ietverto reakciju iespējamo cēloņsaistību ar zālēm. Ne vienmēr tā apstiprinās. Bet, ja apstiprinās, tā tiek atzīta par blakni jeb blakusparādību un ar to tiek papildināti zāļu apraksti un lietošanas instrukcijas zālēm visā ES. Vairāk informācijas par Covid-19 vakcīnu drošuma uzraudzību aicinām skatīt sadaļā “Ikmēneša drošuma pārskati par Covid-19 vakcīnām”.
Svarīgi! Viens saņemtais blakusparādību ziņojums ir tikai kā gabaliņš no puzles un tā izvērtējums vēl neliecina par drošuma problēmu zālēm. Lai iegūtu pilnu ainu par reakciju un noteiktu tās saistību ar zālēm (vai tā ir vai nav blakusparādība), nepieciešami dati arī no citiem ziņojumiem visā Eiropā un pasaulē.
Visās ES dalībvalstīs saņemto zāļu blakusparādību ziņojumu zinātniskā izvērtēšana ir vienāda un tiek īstenota pēc vienota zāļu drošuma uzraudzības standarta.
Tas nozīmē, ka ZVA zinātniski izvērtē ziņotās blakusparādības (reakcijas) cēloņsaistību ar zālēm, balstoties uz zinātniskām metodēm un prasībām, kas ir vienādas visā ES.
Zāļu iespējamu blakusparādību ziņojums nav sūdzība. Zāļu blakusparādību ziņojums ir dalīšanās ar informāciju par iespējamu blakusparādību (jeb veselības traucējumiem) un iesaistīšanās zāļu drošuma uzraudzībā (kuru izvērtēšanas rezultātā var tikt papildinātas lietošanas instrukcijas, zāļu apraksti, sniegti brīdinājumi veselības aprūpes speciālistiem par piesardzību lietošanā).
Informācija par visā ES un Eiropas ekonomikas zonā (EEZ) saņemtiem zāļu blakusparādību ziņojumiem ikvienam ES iedzīvotājam ir publiski pieejama tīmekļvietnē www.adrreports.eu. Vēršam uzmanību, ka šajā datubāzē ir iekļauti visi EEZ saņemtie ziņotie gadījumi neatkarīgi no tā, vai tajos ziņotie veselības traucējumu ir vai nav cēloniski saistāmi ar zālēm.













