Ziņošana EudraVigilance sistēmā
Zāļu blakusparādību ziņojumu (ICSR) iesniegšana EudraVigilance sistēmā
Saskaņā ar Eiropas Savienībā spēkā esošiem normatīviem aktiem (Direktīva 2001/83/EK ar grozījumiem un Regula Nr. 726/2004) cilvēkiem paredzēto reģistrēto zāļu blakusparādību ziņojumi kopš 2005. gada novembra jāiesniedz elektroniski. Ziņošanu un datu apmaiņu par zāļu blakusparādībām veic elektroniskā datu apmaiņas sistēmā EudraVigilance.
Zāļu reģistrācijas apliecības īpašnieks Latvijā novērotus zāļu blakusparādību ziņojumus elektroniski nosūta EudraVigilance pēcreģistrācijas moduļa darba vidē (EudraVigilance Human Post-Authorisation Module, production environment).
Saņēmēja identifikators ir EVHUMAN.
Būtiski ievērot sekojošo:
- Par visām novērotām būtiskām (serious) zāļu blakusparādībām ziņojumi elektroniski jānosūta ne vēlāk kā 15 dienu laikā pēc informācijas saņemšanas.
- Par visām novērotām mazāk būtiskām (non-serious) zāļu blakusparādībām ziņojumi elektroniski jānosūta ne vēlāk kā 90 dienu laikā pēc informācijas saņemšanas.
Kontaktinformācijai:
Kristīne Plensnere, tālr.+371 67078438, e-pasts: kristine.plensnere@zva.gov.lv
Blakusparādību ziņojumu statistika
Latvijā novēroto zāļu blakusparādību datubāzi Zāļu valsts aģentūra (ZVA) veido kopš 2001. gada, un kopš 2004. gada ziņojumu informācija tiek nosūtīta arī uz Eiropas Savienības datubāzi EudraVigilance zāļu jaunu risku identificēšanai. Ik gadu ZVA veic informācijas analīzi Latvijas datubāzē, tostarp par ziņošanas aktivitāti Latvijā.
2017. gadā saņemto zāļu blakusparādību ziņojumu skaits ir palielinājies līdz 588 (skat. 1. attēlu). Saistībā ar EudraVigilance jaunās ziņošanas sistēmas ieviešanu 2017. gadā, kas noteikta Eiropas normatīvo aktu līmenī, pieaudzis reģistrācijas apliecības īpašnieku sniegto ziņojumu skaits.
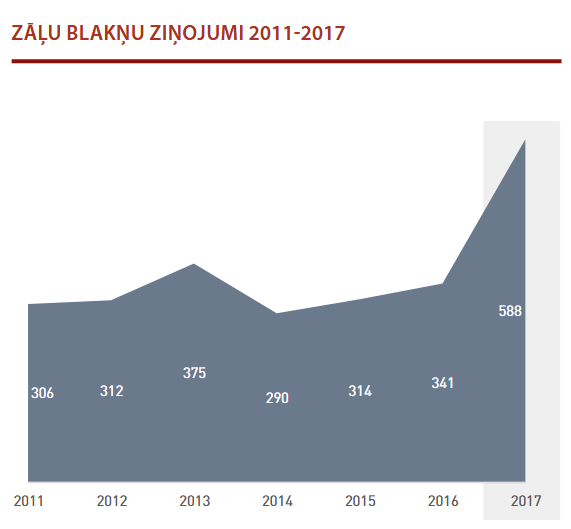
No ārstiem un farmaceitiem tika saņemti 49 ziņojumi. Arī Slimību profilakses un kontroles centrs ir sniedzis 34 ziņojumus par vakcīnu blaknēm.
Par vienu un to pašu blaknes gadījumu var tikt saņemti vairāki ziņojumi, jo viens un tas pats vai cits ziņotājs var iesniegt papildu ziņojumus. Tādēļ nozīmīgs rādītājs ir blakņu klīnisko gadījumu skaits, par ko ZVA konkrētā gadā ir ziņots. Klīnisko gadījumu skaits, par ko ir paziņots Zāļu valsts aģentūrai, 2017. gadā palielinājies līdz 468 (skat. 2. attēlu).
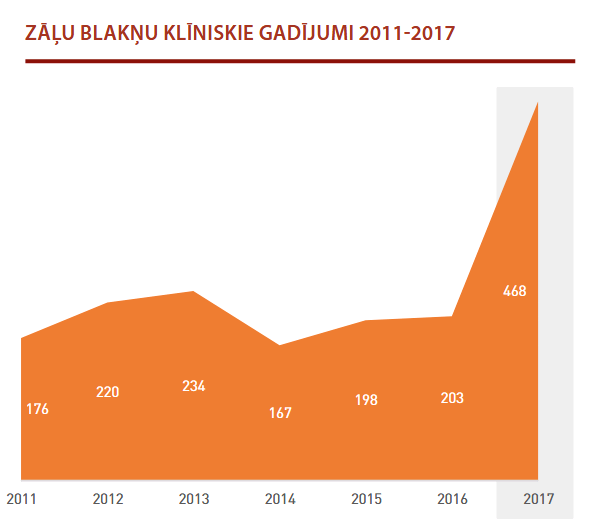
Lai ikviens varētu iegūt datubāzē EudraVigilance publicēto informāciju, Eiropas Zāļu aģentūra šo informāciju ievieto mājaslapā www.adrreports.eu.













